Если бы кто-то описал вам визуализацию кальция in vivo, это могло бы показаться довольно простым. Когда вы копнете глубже, вы начнете понимать сложность, связанную с биологией и оборудованием для выполнения визуализации кальция у свободно движущихся животных. Вы, вероятно, хотели бы узнать, какие составляющие необходимы для выполнения визуализации кальция in vivo.
Биологическая составляющая
Мозг естественным образом не экспрессирует генетически закодированные кальциевые индикаторы (GECIs), что означает, что существуют биологические шаги для выполнения визуализации кальция у свободно движущихся животных. Во-первых, необходимо выразить генетический индикатор в мозге; и, во-вторых, требуется имплантировать зонд визуализации для сбора флуоресцентных сигналов из мозга.
Экспрессия генетического сенсора
Первый и самый важный шаг - это достижение оптимальной экспрессии GECI в вашей животной модели. Мыши являются наиболее распространенной моделью животных, используемой для визуализации кальция in vivo благодаря успеху их генетической модели (Daigle et al. 2018); однако, кальциевая визуализация медленно прогрессировала у крыс и нечеловеческих приматов (Scott et al. 2018; Kondo 2018).
Нейробиологи используют два метода для экспрессии GECIs в мозге: вирусная экспрессия и трансгенные модели мышей. Вирусная экспрессия включает в себя инъекцию вируса, кодирующего GECI в мозг. Этот вирус связан с геном, представляющим интерес для целевой экспрессии в определенном типе клеток. Решающим шагом, связанным с экспрессией вируса, является тестирование различных растворов вируса для получения оптимальной экспрессии в головном мозге (Resendez et al. 2016). Слишком малая экспрессия может привести к отсутствию сигнала, а чрезмерная экспрессия может привести к высокой фоновой флуоресценции или даже к гибели клеток.
Нейробиологи используют вирусную экспрессию для регуляции экспрессии GECI. Это полезно, потому что экспрессия может варьироваться в зависимости от области мозга, типа клеток или вируса. Кроме того, нейробиологи могут использовать вирусную экспрессию для экспрессии GECIs в проекциях мозга для отображения нейронных цепей в различных областях мозга.
По сравнению с ручными вирусными инъекциями, трансгенные модели мышей предназначены для экспрессии GECI во всем мозге (Dana et al. 2014). В зависимости от трансгенной модели экспрессия GECI может варьироваться от области к области, так что одна область может экспрессировать GECI больше, чем другая. Нейробиологи, исследующие большие области коры головного мозга, используют эти модели, а не отдельные зоны интереса, поскольку трансгенные модели требуют гораздо более широкой экспресиии, (Dana et al. 2014).
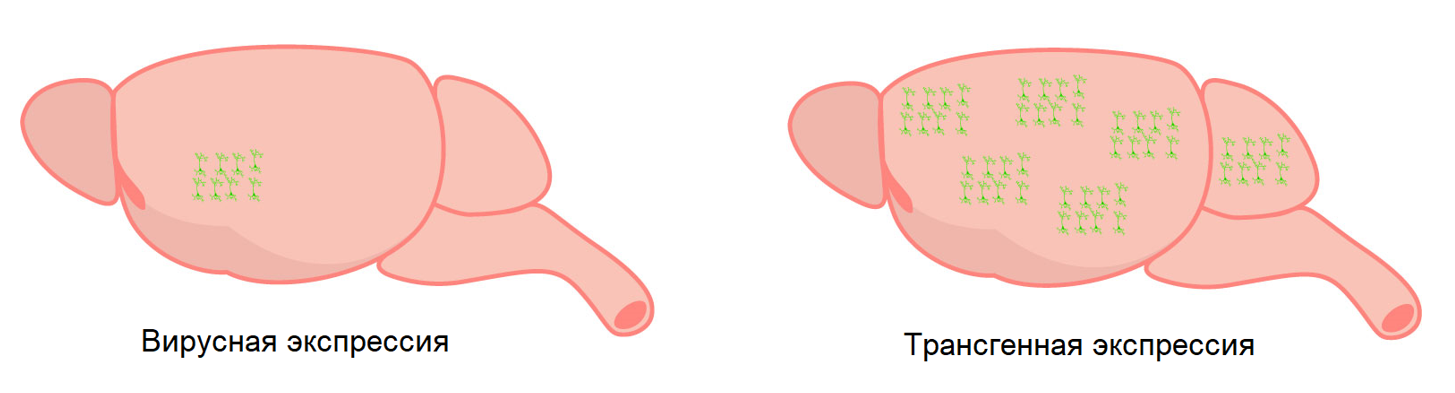
GECIs может быть выражен через вирусную экспрессию (слева), и это ограничивает экспрессию определенным типом клеток и локализует в определенной области мозга. Для сравнения, трансгенная экспрессия (справа) широко распространена во всем мозге.
Имплантация зонда визуализации
После успешной экспрессии GECI вам нужно получить доступ к флуоресцентному сигналу внутри мозга. Но как можно заглянуть в мозг, если он закрыт кожей и черепом?
Как правило, это включает в себя хирургическую имплантацию визуализирующего зонда в мозг, где экспрессируется GECI. Существует три типа зондов (оптическая канюля, кортикальное окно, GRIN-линза с градиентным показателем преломления), которые используются для визуализации кальция in vivo. Выбранный вами зонд зависит от двух факторов:
1. Требуется ли вам изображение с клеточным разрешением
2. Будете ли вы визуализировать глубокую область или только поверхность мозга
Оптические канюли позволяют доставлять и собирать свет из мозга. Эти зонды используются в экспериментах по волоконной фотометрии. Из-за своей конструкции оптические канюли способны собирать только один сигнал или сигнал от популяции, обеспечивая в лучшем случае небольшое пространственное разрешение для изображения отдельных клеток. В зависимости от длины оптической канюли, они могут быть использованы для сбора сигнала в близких к поверхности или глубоких областях мозга. Еще одним бонусом является то, что оптические канюли наименее инвазивны благодаря компактной конструкции, которая повреждает наименьшую область.
В отличие от этого, кортикальные окна заменяют большую часть черепа стеклянным окном. Нейробиологи используют кортикальные окна при визуализации большой кортикальной области на поверхности мозга. Кортикальные окна обеспечивают доступ к коре головного мозга для записи с разрешением в одну клетку.
GRIN линза - это микроэндоскопический зонд, который может быть имплантирован в мозг для получения изображения глубоких областей мозга (до 8 мм) с одноклеточным разрешением. GRIN линзы различаются по длине, что позволяет нейробиологам получать изображения неглубоких и глубоких областей мозга. Чтобы свести к минимуму повреждение тканей, GRIN линзы, как правило, ограничены в диаметре (0.5 мм-1 мм). Диаметр GRIN линзы ограничивает поле обзора, и, таким образом, визуализация обычно обеспечивает относительно небольшое поле обзора, особенно по сравнению с кортикальными окнами.
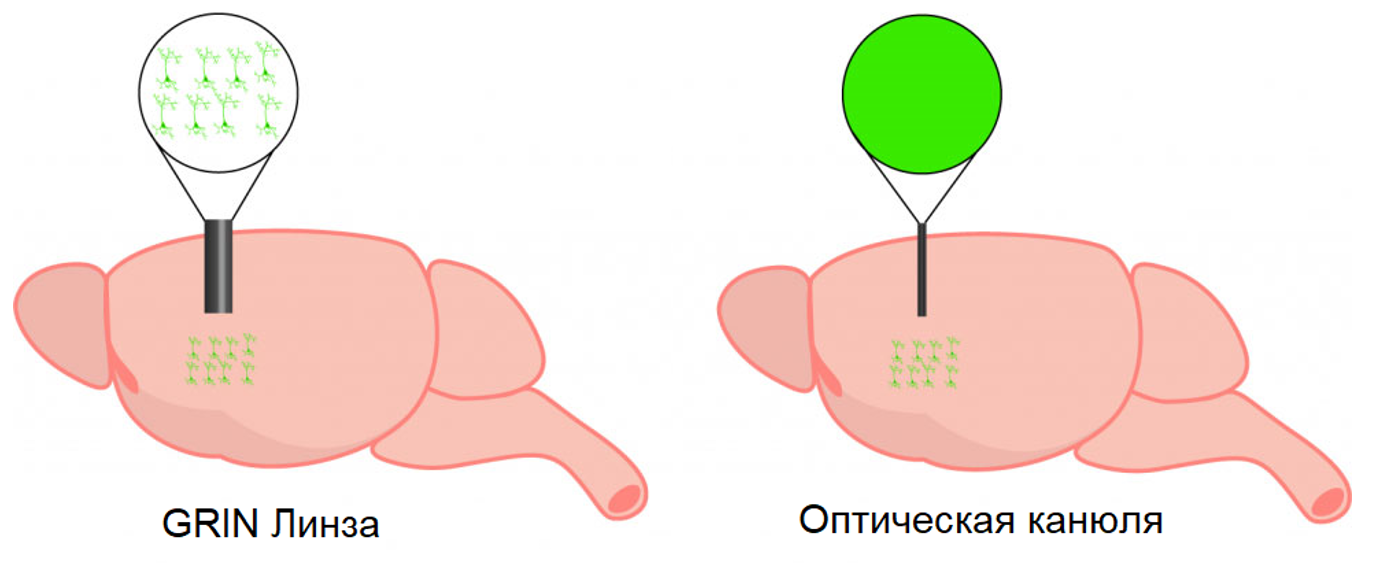
Имплантация GRIN линзы (слева) обеспечивает клеточное разрешение и позволяет визуализировать активность отдельных нейронов. Для сравнения, имплантация оптической канюли (справа) не обеспечивает клеточного разрешения и позволяет визуализировать активность популяции.
Оборудование
Теперь, когда у вас есть все биологические компоненты, включая оптимальную экспрессию GECI и имплантацию зонда визуализации, вам нужно оборудование для записи флуоресцентных сигналов из мозга свободно движущегося животного.
Системы, доступные в настоящее время для визуализации кальция in vivo, состоят из трех основных компонентов:
1. Связь между зондом и устройством обработки изображений
2. Набор источников света и фильтров
3. Устройство отображения
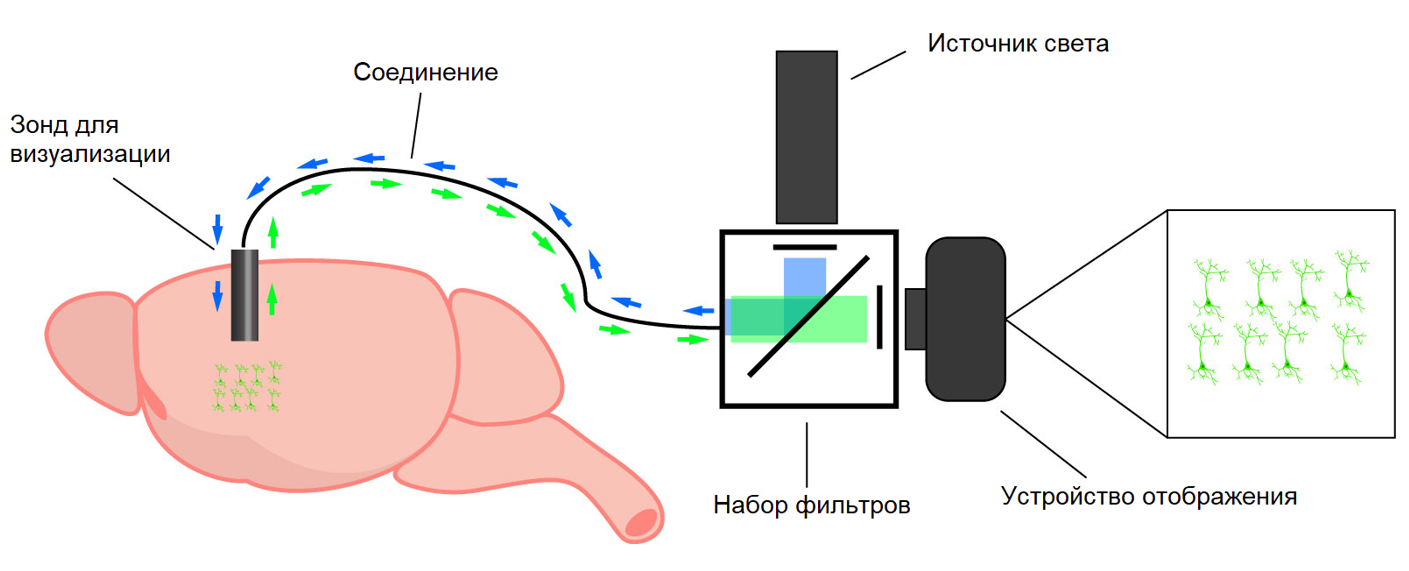
Большинство систем визуализации кальция in vivo состоят из следующих компонентов: 1) зонд визуализации, 2) соединение между источником света и зондом визуализации, 3) источник света, 4) набор фильтров и 5) устройство отображения.
Соединение между зондом и системой визуализации
Флуоресцентный сигнал испускается из GECI, и он передается через зонд визуализации. Но как можно собрать сигнал?
Во-первых, требуется связь между зондом визуализации, источником света и устройством визуализации. Это соединение позволяет освещать GECI в мозге через зонд визуализации и передавать сигнал излучения на камеру. В зависимости от конструкции кальциевой системы визуализации соединение может быть достигнуто с помощью волокна визуализации или оптического волокна, или система (например, минископ) может быть непосредственно установлена на голове животного.
Набор источников света и фильтров
Соединение позволяет вам освещать и собирать флуоресцентные сигналы от мозга. GECIs функционируют путем генерации сигналов флуоресценции, так что они имеют спектр возбуждения и излучения (Grienberger & Konnerth 2012). Для возбуждения GECIs и сбора излучающего сигнала вам потребуются два компонента: источник света и дихроики/фильтры.
Для возбуждения GECI обычно выбирают светодиодные источники света для визуализации кальция in vivo, так как требуется низкая оптическая мощность. Однако, если освещается большая область, может потребоваться лазер. Существует баланс между слишком малой и слишком большой мощностью: получение недостаточного сигнала и фотообесцвечивание образца.
Важно, чтобы была выбрана правильная длина волны возбуждения. Например, GCaMP возбуждается синим излучением (~470нм) и испускает зеленое (~530нм). И именно здесь необходим второй компонент. Дихроики и фильтры обеспечивают передачу правильной длины волны возбуждения и передачу корректного сигнала излучения на устройство формирования изображения.
Устройство визуализации
Наконец, нужно собрать и проанализировать флуоресцентные сигналы от мозга. Это стало возможным с помощью устройства визуализации. Для систем визуализации in vivo используются три типа устройств визуализации: 1) научная камера, 2) фотоэлектронный умножитель и 3) фотоприемник. Какое устройство визуализации используется, в некоторой степени зависит от системы визуализации кальция.












