Флуоресцентная микроскопия плоскостного освещения
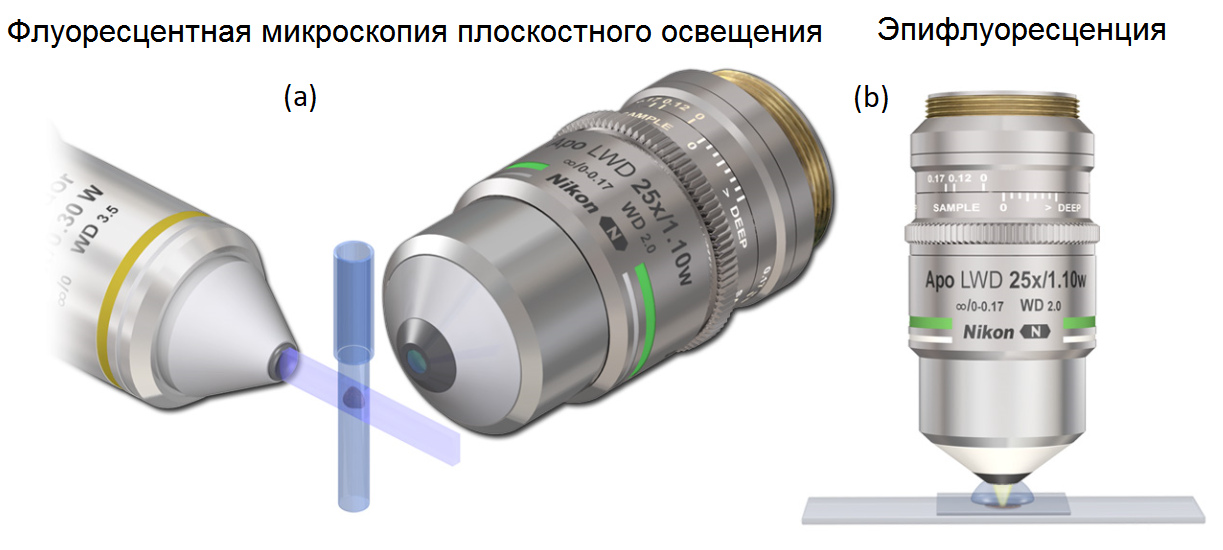
Сравнение геометрии освещения и детектирования флуоресцентной микроскопии плоскостного освещения с эпифлуоресценцией. (a) Геометрия флуоресцентной микроскопии плоскостного освещения: объектив с малой числовой апертурой, проецирует световой «лист» на образец. Флуоресценция детектируется с помощью объектива с большой числовой апертурой, ориентированного ортогонально первому объективу и проецируемому световому «листу». (б) Типичная эпископическая геометрия освещения и детектирования, где возбуждение и детектирование выполняются с использованием общего объектива и общего пути распространения света.
Флуоресцентная микроскопия плоскостного освещения — это общее название для постоянно растущего семейства методов плоскостного освещения, которые произвели революцию в том, как может быть выполнена оптическая визуализация биологических образцов. По сути, методы флуоресцентной микроскопии плоскостного освещения становятся возможными благодаря разделению оптических путей освещения и детектирования, что позволяет применять новые стратегии освещения, которые оптимизируют эффективность сбора фотонов в приборе. Эта общая концепция иллюстрируется рисунком 1 выше. Световой «лист» формируется с помощью лазерного излучения, либо в форму гиперболического «листа», либо аппроксимируется путем сканирования слабо сфокусированного луча с малой апертурой в поперечных направлениях, как в традиционных лазерных сканирующих микроскопах. Важно отметить, что детектирование выполняется вдоль оси, отличной от оси освещения, чаще всего в ортогональном направлении, чтобы максимально увеличить эффективность детектирования путем минимизации флуоресценции от элементов вне фокуса.
При стандартных эпископических подходах (то есть конфокальных и широкополосных) конус освещения и детектирования растягивается в осевом направлении (z), возбуждая сильный флуоресцентный сигнал от областей, находящихся вне фокуса и ухудшая качество сигнала от областей образца, находящихся в фокусе, как показано на рисунке 2 ниже. С помощью флуоресцентной микроскопии плоскостного освещения можно использовать более низкие интенсивности освещения в сочетании с плоским (или иным образом структурированным) освещением для обеспечения улучшенного отношения сигнал/шум с минимальной экспозицией образца, что позволяет получать изображения с высокой частотой кадров и в течение длительных периодов времени. Сканирование светового «листа» или образца в осевом направлении позволяет получать 3D-изображения быстро и нанося минимальный вред образцам.
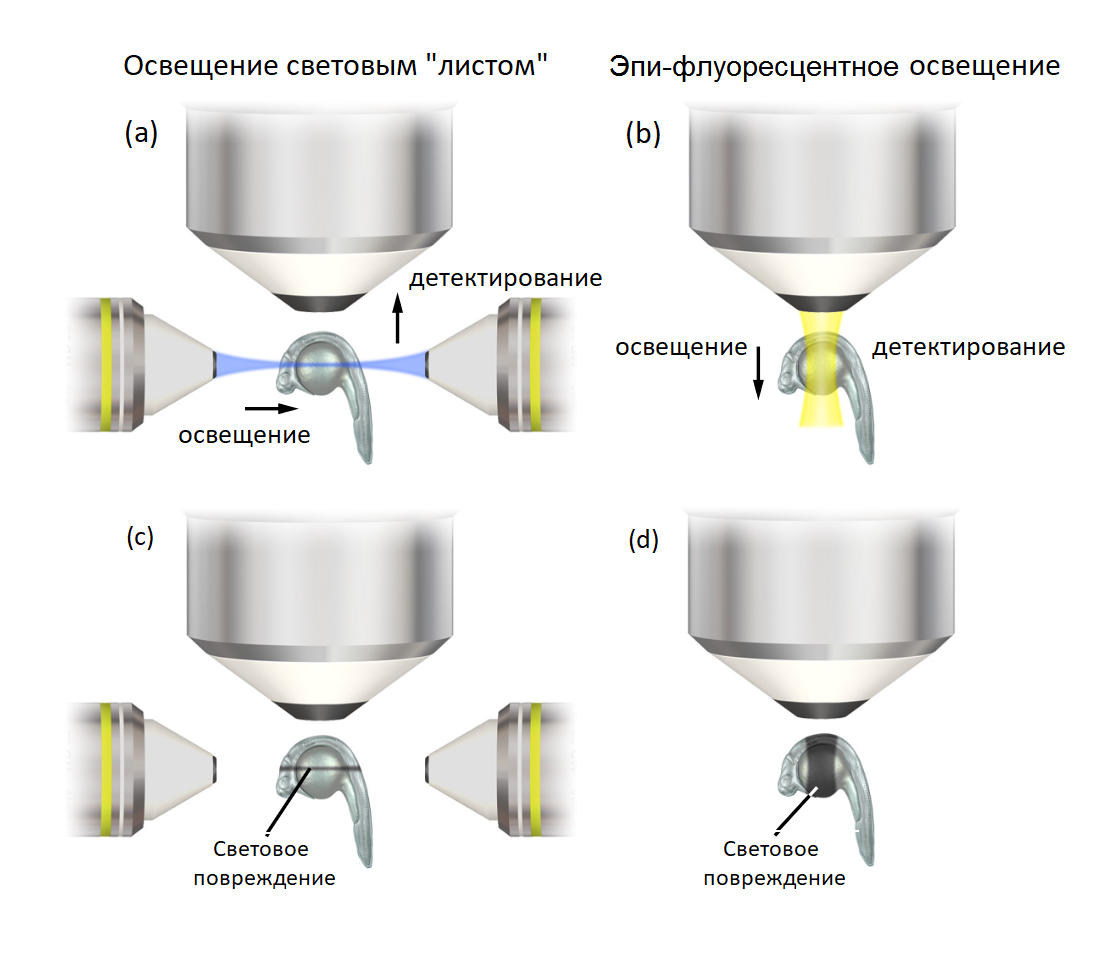
Рис. 2 Световая экспозиция в флуоресцентной микроскопии плоскостного освещения и при эпи-флуоресценции
Сравнение светового «листа» и традиционного эпископического освещения. (а) Иллюстрация плоского освещения, обеспеченного парой осветительных объективов. (б) Типичное широкополосное освещение с большой долей освещения за пределами глубины резкости объектива. (c) Облучается только тонкий участок образца, который затем обесвечивается с помощью плоского освещения. (d) Эпи-освещение приводит к облучению гораздо большего объема образца, большая часть которого не в фокусе, а также к ухудшению сигнала в фокусе. Флуоресцентная микроскопия плоскостного освещения может значительно уменьшить фотообесцвечивание и другие фототоксические эффекты через осевое ограничение освещения.
Осевое ограничение освещения приводит к значительному снижению фотообесцвечивания и фототоксичности, что позволяет осуществлять долгосрочную визуализацию в течение многих дней или даже недель. Тем не менее, флуоресцентная микроскопия плоскостного освещения может быть трудной в реализации, обычно требующей двух или более объективов, нестандартных протоколов подготовки образцов, сложных процедур выравнивания лучей света и хорошо спланированного рабочего процесса для обработки огромных объемов данных, полученными такими методами (часто в терабайтах). Области, которые существенно выигрывают благодаря использованию флуоресцентной микроскопии плоскостного излучения, включают биологию развития / эмбриологию, нейробиологию, исследование лекарств, биологию растений и многое другое. В этой статье будут рассмотрены основы флуоресцентной микроскопии плоскостного освещения (включая краткую историю), рассмотрены различные варианты ее реализации и применения, а также рассмотрены основные аспекты подготовки образца.
Историческая справка
В основе флуоресцентной микроскопии плоскостного освещения лежит методика, называемая «ультрамикроскопия», впервые предложенная в 1902 году Рихардом Адольфом Зигмонди, химиком-органиком и физиком-экспериментатором, и Генри Зидентопфом, физиком-оптиком. Первоначальный ультрамикроскоп сфокусировал солнечный свет для бокового освещения растворов коллоидного золота для получения картины рассеяния, детектируемой ортогонально к плоскости освещения. Этот подход значительно увеличил отношение сигнал/шум по сравнению с существующими методами, делая возможным наблюдение отдельных молекул золота. Французский ученый Жан Перрен продолжил работу Зигмонди, применив ультрамикроскопию для составления графика движения частиц, предоставляя бесценные доказательства броуновского движения. Позже Зигмонди был удостоен Нобелевской премии по химии за работу с ультрамикроскопией и коллоидными растворами. Изображение первоначального ультрамикроскопа Зигмонди приведена на рисунке 3. В течение многих лет этот метод был в значительной степени забыт, поскольку в 1960-х годах плоскостное освещение стало не так широко использоваться в области фотомакрографии, которая получила популярность благодаря микроскопу «Dynaphot».

Рис. 3 Система Ричарда Зигмонди
Изображение ультрамикроскопа Ричарда Зигмонди. Осветитель находится справа, а микроскоп - слева, с ортогонально установленным объективом для передачи освещения.
Первая комбинация плоскостного освещения с флуоресцентной микроскопией появилась в 1993 году, когда Арне Вои и Дэвид Бернс из лаборатории Фрэнсиса Спелмана в Вашингтонском университете впервые применили флуоресцентную микроскопию с оптическими сечениями в ортогональной плоскости (OPFOS) для визуализации и создания карты улитки внутреннего уха морской свинки. Одной из проблем, с которой столкнулся Вои, была непрозрачность богатой кальцием кости. Атомы кальция сильно рассеивают свет, делая оптическую визуализацию через кость практически невозможной, однако они могут быть удалены с помощью 10% раствора ЭДТА в воде. Затем их группа использовала раствор, по столетней рецептуре, известный как раствор Шпальтегольца, состоящий из смеси масел для аппроксимации показателя преломления белка.
Изображения, полученные Вои и его коллегами были сравнимы по качеству с изображениями, полученными с помощью высокочувствительных томографических методов, таких как рентгеновская микрокомпьютерная томография (мкКТ), но с превосходной способностью распознавать структуры мягких тканей. Это важно, так как Вои и его коллеги пытались соотнести морфологию волосковых клеток с потерей слуха, поэтому у них была необходимость получить изображение ткани с высокой точностью. Соответствующие рентгеновская микрокомпьютерная томография и флуоресцентная микроскопия с оптическими сечениями в ортогональной плоскости будут реализованы позже. Обратите внимание, что в этой и последующих работах группы Спелмана флуоресцентная микроскопия с оптическими сечениями в ортогональной плоскости будет рассматриваться как томографический метод, но не обязательно для разрешения субклеточных структур, поскольку они продемонстрировали продольное разрешение 10 мкм и осевое разрешение 26 мкм с очень широким полем зрения 1,5 мм х 1,5 мм. Однако, несмотря на успех флуоресцентной микроскопии с оптическими сечениями в ортогональной плоскости, флуоресцентная микроскопия плоскостного освещения останется относительно неясной техникой в течение нескольких лет.
В 1994 году Эрнст Х. К. Стелцер и Стеффен Линдек из Европейской лаборатории молекулярной биологии (EMBL) опубликовали статью, описывающую новую методику: конфокальную тета-микроскопию. Этот метод использует оптику для освещения и детектирования, расположенную ортогонально друг другу, подобную современным системам флуоресцентной микроскопии плоскостного освещения, но как часть конфокального микроскопа с точечным сканированием. Функции рассеивания точек освещения и детектирования перекрываются только в их общем фокусе, что приводит к увеличению осевого разрешения в 3-4 раза по сравнению с обычными методами конфокальной визуализации.
В 2002 году флуоресцентная микроскопия плоскостного освещения приобрела новый интерес, когда Эран Фукс и его коллеги применили тонкослойную флуоресцентную микроскопию на световых «листах» для визуализации невозмущенной водной микроокружающей среды, особенно образцов морской воды. Несмотря на то, что определение «тонкий» использовался для светового «листа», размеры аналогичны тем, которые первоначально использовались для флуоресцентной микроскопии с оптическими сечениями в ортогональной плоскости, толщина перетяжки луча 23 мкм и поле зрения 1 х 1 мм. Одна из причин, почему их группа выбрала тонкослойную флуоресцентную микроскопию плоскостного освещения, это возможность обнаружить бактерию c помощью интеркалирующего красителя SYBR Green I без последующей фильтрации бактерии из образца морской воды для удаления свободного красителя. Тонкослойная флуоресцентная микроскопия плоскостного освещения показала достаточно хорошую чувствительность для того, чтобы изобразить помеченную бактерию с минимальным фоном от красителя в растворе. Хотя конфокальная микроскопия могла обеспечить оптическое секционирование и уменьшить фон, тонкослойная флуоресцентная микроскопия на световых «листах» делает это с превосходной скоростью и со значительно лучшим отношением сигнал/шум, что важно для захвата динамики движения быстродвижущихся микробов.
Наконец, в 2004 году группа Штельцера представила разновидность конфокальной техники с использованием плоских световых «листов» и широкопольного (а не конфокального) детектирования, опубликовав свой документ, посвященный селективной микроскопии плоскостного освещения (Selective Plane Illumination Microscopy - SPIM). Хотя селективная микроскопия плоскостного освещения показала относительно незначительные технические различия по сравнению с ее предшественниками, настоящим прорывом стало ее применение в визуализации живых трансгенных GFP-экспрессирующих организмов, включая GFP-меченую мышцу в естественно-прозрачной рыбе Medaka Oryzias latipes и эмбриогенез обыкновенной плодовой мухи Drosophila melanogaster с использованием GFP-моэсина (маркер плазматической мембраны). Это одно из самых популярных приложений флуоресцентной микроскопии плоскостного освещения для флуоресцентной визуализации эмбриогенеза на сегодняшний день. Введение селективной микроскопии плоскостного освещения ознаменовало очень важный шаг в развитии флуоресцентной микроскопии плоскостного освещения, спустя годы после ее открытия, она пройдет через взрыв новых методов и улучшений, которые мы рассмотрим подробно.
Световые "листы"
Свойства световых «листов»
Возможно, наиболее важным компонентом любой флуоресцентной микроскопии плоскостного освещения является сам световой «лист», который может принимать форму статического плоского «листа», как это было изначально в селективной микроскопии плоскостного освещения, или сканирующий луч, аппроксимирующий световой «лист» с течением времени. Каждый метод имеет свои преимущества и недостатки, но важно понимать некоторые фундаментальные свойства световых «листов». Рисунок 4 иллюстрирует различные типы световых «листов» и важные параметры, обсуждаемые здесь.
Во-первых, невозможно создать идеально плоский световой «лист», его можно только аппроксимировать и только в заданном диапазоне. Осевое разрешение в конечном итоге ограничено толщиной светового «листа» и числовой апертурой детектирующего объектива. Как статические плоские, так и световые «листы», получаемые путем сканирования, имеют гиперболический профиль в плоскости xz (рис. 4), при этом перетяжка луча (w0) задает толщину наиболее плотно сфокусированной средней точки профиля освещения и рассчитывается по следующему уравнению:
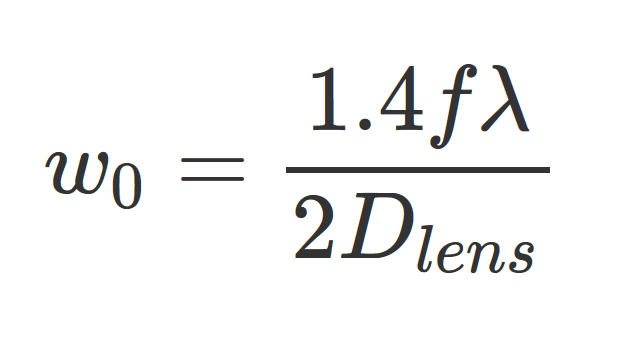
Где w0 - толщина перетяжки луча, f - фокусное расстояние осветительной оптики, λ – используемая для освещения длина волны, а Dlens – диаметр диафрагмы осветительной оптики. Особую озабоченность вызывает конфокальный параметр (b) светового «листа», который определяет расстояние, на котором можно сказать, что лист обеспечивает почти гомогенное плоское освещение. Расстояние от центра до места, где перетяжка пучка увеличивается в корень из 2 раз в одном направлении составляет длину Рэлея (XR), которая по определению составляет половину конфокального параметра. Таким образом, конфокальный параметр определяет максимально полезную продольную протяженность светового «листа» в направлении распространения. Увеличение параметра конфокальности за счет создания большего светового «листа» напрямую приводит к увеличению перетяжки пучка (ограничение осевого разрешения), как описано в приведенном ниже уравнении, касающемся параметра конфокальности и толщины перетяжки пучка:
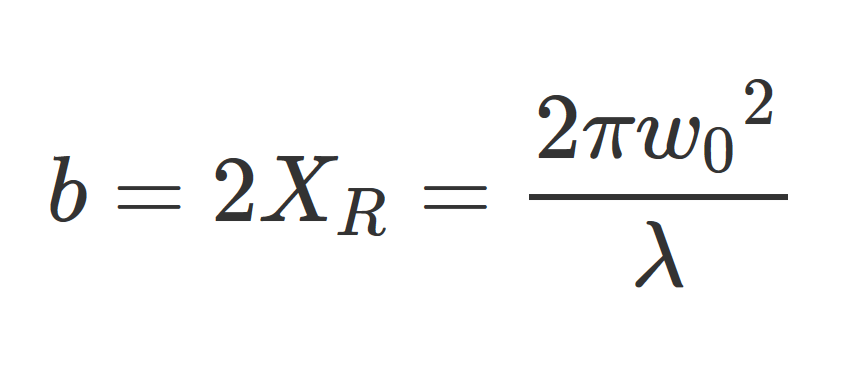
Где b - конфокальный параметр, XR - длина Рэлея, w0 - толщина перетяжки пучка, а λ - используемая для освещения длина волны. Например, если выбрана толщина светового листа ~ 2 микрометра, и визуализация выполняется с использованием зеленого света с длиной волны 561 нм, конфокальный параметр будет составлять приблизительно 22.4 мкм, что достаточно для визуализации отдельных клеток, но не для получения изображений более крупных образцов. Для сравнения, световой «лист» с перетяжкой пучка w0 = 10 мкм имеет конфокальный параметр b со значением более 1 мм. Следует отметить, что эти уравнения предназначены для характеристики световых «листов», распространяющихся в воздухе (показатель преломления n = 1.0), в среде с показателем преломления n, конфокальным параметром становится:
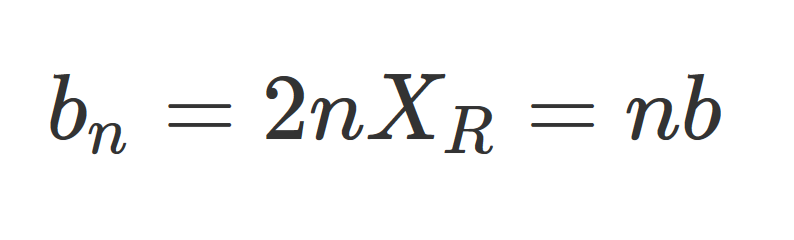
Где n - показатель преломления среды, а bn - конфокальный параметр в среде с показателем преломления n. Таким образом, можно расширять световые листы, позволяя им распространяться в материалах с более высоким показателем преломления, таких как вода (n = 1,33). Исследователи уделяют внимание специализированным подходам к расширению конфокального параметра световых «листов» без утолщения перетяжки пучка с использованием специализированных методов, которые будут обсуждаться более подробно. Нужно иметь в виду, что представленные уравнения могут использоваться для характеристики не только статических плоских световых «листов», но и «виртуальных» световых «листов», созданных сканирующим лучом.
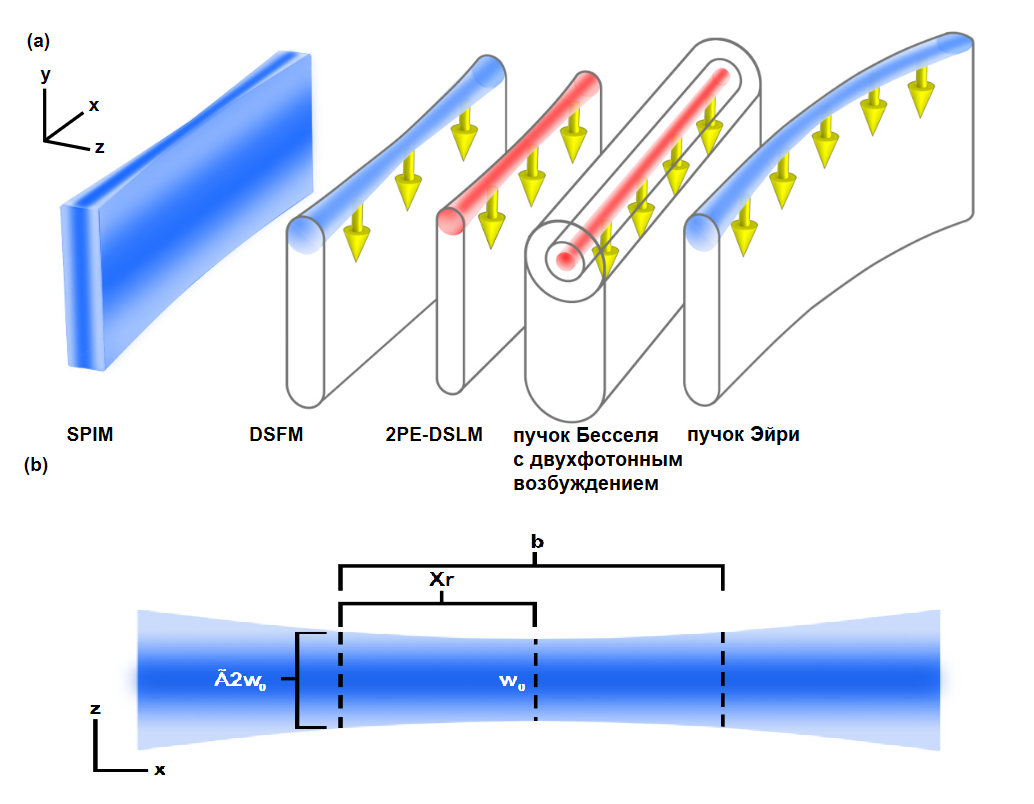
Рис. 4 Варианты световых «листов» и основные параметры
Плоские световые «листы»
Более старые методы флуоресцентной микроскопии плоскостного освещения, такие как флуоресцентная микроскопия с оптическими сечениями в ортогональной плоскости, использовали одну цилиндрическую линзу для создания и проецирования светового «листа» в образец. Как и сферические линзы, цилиндрические линзы используются для рассеивания или фокусирования света, но только вдоль одной оси. Более сложные итерации техники используют цилиндрическую линзу в сочетании с объективом для улучшения оптических свойств светового «листа».
Сканирующие световые «листы»
Одно из решений для разрыва взаимозависимости между параметром конфокальности и толщиной перетяжки пучка заключается в сканировании в боковых направлениях для получения тонкого светового «листа» и последующем сшивании участков изображения вместе для создания составного изображения большего размера, чем диктуется одним только параметром конфокальности. Этот подход использовался в флуоресцентной микроскопии с оптическими сечениями в ортогональной плоскости с высоким разрешением (HR-OPFOS) и в лазерной сканирующей микроскопии с «тонким листом» (sTSLIM), а также применялся для визуализации мозжечка мыши и улитки внутреннего уха. Недостатком этого подхода является то, что он требует бокового, а также осевого сканирования, что приводит к увеличению времени сбора данных и большей экспозиции, что частично сводит на нет одно из главных преимуществ флуоресцентной микроскопии плоскостного освещения - выборочное освещение только тех объектов, которые должны быть отображены. Кроме того, при регистрации и сшивании изображений также могут возникать проблемы несмотря на то, что алгоритмы регистрации в последние годы улучшились и позволяют использовать проверочные метки для регистрации местоположения особенностей образцов.
Как правило, образец сканируется в осевом направлении с помощью светового «листа» для генерации z-серий, однако объективы могут быть смещены относительно стационарного образца. В последнее время многие исследовательские группы решили использовать стандартные лазерные гауссовские лучи, а не световой «лист», сканируя луч в боковом направлении, чтобы имитировать плоский световой «лист». Затем следует осевой сдвиг луча с использованием сканирующего f-theta объектива и соответствующих сканирующих зеркал, что позволяет получить полную серию без перемещения объектива или образца. Этот подход называется цифровой сканирующей лазерной микроскопией плоскостного освещения (DSLM) и был разработан Филиппом Келлером и его коллегами в 2008 году.
Многофотонные «световые» листы
Как плоские, так и цифровые сканирующие световые «листы» могут использоваться в сочетании с многофотонным возбуждением. Двухфотонное возбуждение (2PE) происходит, когда флуорофор поглощает два фотона одновремнно, где объединенные энергии подобны той, которая необходима для возбуждения флуорофора в возбужденное состояние с использованием одного фотона. Двухфотонное возбуждение - чрезвычайно редкий процесс в естественном мире, происходящий только при чрезвычайно высокой плотности фотонов, как это реализовано в фокусе очень мощного фемтосекундного импульсного лазера. Длина волны для двухфотонного возбуждения должна быть примерно в два раза больше, чем в типичном однофотонном случае, хотя это скорее ориентир, чем правило, все равно следует обращаться к известным двухфотонным спектрам поглощения.
Поле визуализации несколько уменьшено в размерах при многофотонном возбуждении по сравнению с обычными однофотонными подходами из-за уменьшенной области фокусировки, однако длинноволновый инфракрасный свет, используемый для двухфотонного возбуждения, лучше подходит для проникновения в образец в рассеивающих средах. В самом деле, оптическое окно прозрачности в биологии существует между 650 нм и 1200 нм, где автофлуоресценция минимальна, а поглощение гемоглобином, водой и белком низкое. Это особенно полезно для экспериментов с флуоресцентной микроскопией плоскостного освещения, так как образцы часто имеют толщину несколько миллиметров и сильнее рассеивают и/или поглощают по сравнению с тонкими образцами. Таким образом, основными преимуществами многофотонного возбуждения являются уменьшенное рассеяние/поглощение и, следовательно, более глубокое проникновение в образец. Этой техникой пользуются при работе с длинноволновым излучением в инфракрасной области спектра.
Пучки Бесселя и дискретное освещение
Лаборатория Александра Рорбаха впервые продемонстрировала использование самовосстанавливающихся бесселевых пучков для создания цифрового сканирующего светового «листа». Лучи Бесселя генерируются посредством проекции кольцевого узора на периферию заднего зрачка осветительного объектива или путем формирования освещения с помощью аксикона. В идеальном случае эти лучи можно рассматривать как недифракционные: при наличии препятствия луч Бесселя будет преобразовываться после препятствующего объекта, что можно описать как «самовосстановление».
Пучок Бесселя можно сделать намного тоньше стандартного гауссова пучка, что позволяет получать более тонкие световые «листы». Наиболее существенная проблема, связанная с освещением пучком Бесселя, заключается в том, что большая часть энергии пучка находится в боковых «лепестках», сильнее размывая границы пятна рассеяния, чем на типичной дифракционной картине Эйри. Эти боковые «лепестки» на самом деле жизненно важны для самовосстанавливающихся свойств луча, но они эффективно уменьшают размер перетяжки луча. Одним из решений этой проблемы является сочетание освещения лучом Бесселя и двухфотонного возбуждения, которое было продемонстрировано для формирования очень тонких световых «листов» (менее половины микрометра). Интенсивность освещения луча Бесселя достаточно высока, чтобы достичь двухфотонного возбуждения, эффективно устраняя возбуждение боковыми лепестками областей, находящихся вне фокуса. Используя этот подход, лаборатория Эрика Бетцига продемонстрировала изотропное разрешение 300 нм в живых клетках со скоростью визуализации около 200 изображений плоскостей в секунду. Лучи Бесселя также использовались в сочетании с методом микроскопии некогерентного структурированного освещения (SIM), позволяющим и в вычислительном отношении различать и отклонять информацию о низкой пространственной частоте, возникающую из флуоресцентных структур, находящихся не в фокусе. Преимущества микроскопии структурированного освещения и двухфотонного возбуждения в сочетании с лучами Бесселя аналогичны друг другу.
Развивая идею применения бесселевых пучков к флуоресцентной микроскопии плоскостного освещения, лаборатория Betzig представила новую мощную флуоресцентную микроскопию плоскостного освещения: микроскопия светового листа с дискретным освещением. Вместо использования сканирующих бесселевых пучков этот метод использует аналогичные методы для проецирования "оптических решеток" в плоскость образца. "Оптическая решетка" — это периодическая интерференционная картина, созданная наложением двух или более плоских волн и имеющая 2D или 3D структуру. Однако, в отличие от пучков Бесселя, которые создаются путем ограничения освещения в очень тонкую область в форме кольца на плоскости заднего зрачка осветительного объектива, "оптическая решетка" создается путем освещения отдельных точек вокруг кольца. Дискретная подсветка в виде "оптической решетки" позволяет пользователю выбрать схему, оптимизированную для осевого разрешения или ограничения освещенности.
Микроскопия светового листа с дискретным освещением была продемонстрирована в нескольких различных «режимах». «Стандартный» режим включает быстрое колебание рисунка "оптической решетки" с использованием гальванометра для обеспечения равномерного по времени освещения каждого бокового участка, что приводит к отчетливым усредненным по времени схемам освещения. Режим структурированной подсветки обеспечивает пространственное разрешение примерно в 1.3-1.5 раза больше, чем в режиме с колебанием рисунка, но временное разрешение примерно в 7.5 раз хуже.
Ценность визуализации методом плоскостного освещения с дискретным освещением была продемонстрирована для экспериментов по отслеживанию одиночных молекул и визуализации с супер-разрешением. Небольшие и плотно сфокусированные световые «листы» обычно имеют перетяжку пучка около 4-5 мкм, в несколько раз толще, чем типичная глубина резкости объективов с высокой числовой апертурой. В отличие от этого, колеблющиеся "оптические решетки" имеют эффективную перетяжку луча, близкую к 1 мкм, точнее совпадающую глубиной резкости объективов с высокой числовой апертурой и превосходную для изображения одиночных молекул в высоком разрешении. Ограниченное возбуждение одиночных излучателей в фокусе объектива позволяет детектировать большую долю эмиссии одиночных молекул.
Пучки Эйри
Подобно пучкам Бесселя, пучки Эйри инвариантны к распространению и являются «самовосстанавливающимися». Лучи Эйри формируются путем модуляции типичного гауссова луча в задней апертуре объектива с использованием пространственного модулятора света, что приводит к характерной асимметричной поперечной структуре луча Эйри (рисунок 4). Интересно, что пучки Эйри проходят через толстые и рассеивающие среды даже дальше, чем пучки Бесселя. Световой «лист» Эйри формируется аналогично другим "листам" цифровой сканирующей лазерной микроскопии плоскостного освещения, путем колебания пучка вдоль оси Y, чтобы создать виртуальный «лист» освещения.
Методы визуализации в флуоресцентной микроскопии плоскостного освещения
Визуализация в разных проекциях и направлениях
Одной из наиболее распространенных проблем флуоресцентной микроскопии плоскостного освещения является наличие полос-артефактов. Эти искажения возникают в результате однонаправленного освещения. Элементы образца, которые рассеивают, поглощают или иным образом возмущают падающий луч на поверхности образца, приводят к ослабеванию освещения внутри образца, что приводит к появлению темных «полос». Эти полосы проиллюстрированы на рис. 5 (b, d), где гипотетический образец, содержащий оптически непрозрачные структурные элементы (оранжевые кружки), подвергается одностороннему освещению, а результирующие тени / полосы отчетливо видны на рисунке.
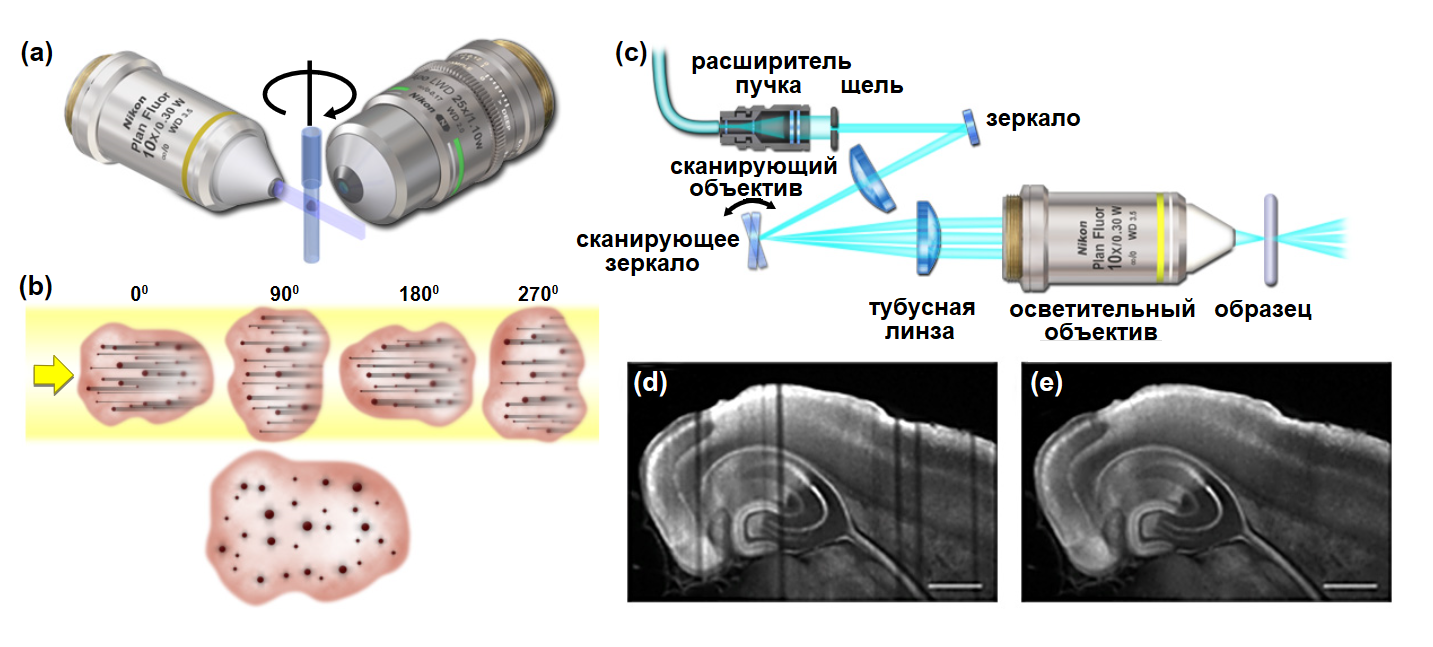
Рис. 5 Артефакты/тени и их коррекция с помощью визуализации нескольких проекций
Одним из первых решением проблемы теней (полос) было применение формирования изображения образца в разных проекциях, реализуемого путем последовательного вращения в плоскости xy и визуализации образца в каждой плоскости z, с последующим объединением изображений каждой проекции для создания высококачественного составного изображения. Обычно, несколько z-стеков регистрируют последовательно, каждый стек для одной проекции. Например, после получения первой серии изображений по z, образец поворачивается на заранее определенный угол для получения второй серии изображений и так далее до тех пор, пока не будет получено необходимое количество изображений, обычно 4-6. После получения окончательного z-стека для каждой проекции составные оптические срезы создаются с использованием специализированных алгоритмов слияния и деконволюции для объединения изображений, создавая в результате изображение высокого разрешения с низкими отклонениями качества по всему объему образца. Преимущества такого изображения более подробно рассматриваются на рисунке 5.
Составное изображение позволяет имитировать однородное освещение каждой плоскости z. Хотя все участки образца освещены не полностью равномерно, особенно при небольшом количестве проекций и при приближении к центру толстых образцов, качество изображения значительно улучшается по сравнению с визуализацией однонаправленным методом. В качестве альтернативы, можно использовать поворот светового "листа". Этот метод называется многонаправленной селективной микроскопией плоскостного освещения (mSPIM). Световые «листы», распространяющиеся от осветительного(ых) объектива(ов), поворачиваются в фокальной плоскости детектирования на угол приблизительно равный 10o с использованием резонансного зеркала, работающего на высокой частоте. Освещение под несколькими углами реализуется практически одновременно от каждого осветительного объектива во время экспозиции камеры, уменьшая помехи освещения без ущерба для скорости захвата, как при визуализации разных проекций. Однако для уменьшения помех этот подход не так эффективен, как мультипроекционная селективная микроскопия плоскостного освещения, поскольку диапазон углов освещения все еще относительно ограничен. Многопроеционную и многонаправленную визуализацию можно комбинировать для повышения чувствительности.
Существуют некоторые вопросы относительно метода визуализации с поворотом образца, в первую очередь потому, что он увеличивает время сбора данных в несколько раз. Вращение образца может быть проблематичным из-за времени вращения, которое, как правило, измеряется в десятках миллисекунд. Медленное вращение необходимо для предотвращения механического напряжения и перемещения образца, что может поставить под угрозу эксперимент или привести к появлению «рывковых» помех, при которых образец резко перемещается между кадрами изображения. Кроме того, каждая плоскость подвергается воздействию освещения в несколько раз дольше, чем в сопоставимых экспериментах в флуоресцентной микроскопии плоскостного освещения с визуализацией одной проекции. Это связано с необходимостью изображения объектов в каждой плоскости 4-6 раз. Такое увеличенное время сбора данных часто препятствует визуализации живых образцов. Таким образом, данная техника в большей степени способствует высококачественной структурной визуализации неподвижных образцов.
Популярной альтернативой и/или дополнением к визуализации нескольких проекций является двухстороннее освещение световым «листом»: пара противоположно направленных осветительных объективов обеспечивают чередующееся (или одновременное) освещение световым «листом» с противоположных сторон образца, что обеспечивает более однородное освещение элементов образца. Детектирующие объективы размещены по-прежнему ортогонально обоим осветительным объективам. Это быстрый и элегантный подход для уменьшения эффекта возникновения полос/теней в результате одностороннего освещения. Кроме того, при правильном выравнивании двусторонняя подсветка может использоваться для эффективного удвоения конфокального параметра, что позволяет использовать «тонкие» световые «листы» для получения изображений более крупных образцов с более высоким разрешением, но без процессов бокового сканирования и сшивания, используемых в sTSLIM, HROPFOS и подобных техниках LSFM.
Как уже говорилось, DSLM и аналогичные методы имитируют световые листы путем сканирования типичного коллимированного лазерного луча с гауссовским распределением как в поперечном, так и в осевом направлении через образец. Одним из основных преимуществ этого метода является то, что он обеспечивает более однородную световую дозировку, чем статические плоские световые "листы". Он предпочтителен для количественных применений визуализации. Кроме того, DSLM не требует апертуры для формирования луча, уменьшая оптические аберрации и приводя к эффективности освещения приблизительно 90-95%, по сравнению с приблизительно 5% для плоских световых "листов". Это позволяет использовать гораздо более дешевые и маломощные лазерные источники света. Наконец, DSLM и связанные с ним методы позволяют создавать новые схемы освещения посредством модуляции интенсивности освещения с помощью акустооптического перестраиваемого фильтра (AOTF).
Многие недавние стандартизированные подходы к высокочувствительным LSFM предполагают использование четырех объективов: двух для освещения и двух для детектирования. Большим преимуществом этого метода является то, что он удваивает количество света, собираемого в каждой плоскости. Стандартизированные платформы обработки изображений SiMView и MuVi-SPIM популяризируют данную технику. Совсем недавно был введен вариант IsoView, в соответствии с которым возбуждение световым листом и детектирование флуоресценции выполняются четырьмя изготовленными на заказ объективами последовательно, и каждый из них имеет собственную камеру sCMOS для регистрации, что позволяет собирать регистрировать четыре проекции без физического вращения образца. В ранней технике, получившей название микроскопии с несколькими осями визуализации (MIAM), также использовались 4 объектива, но они были расположены в форме тетраэдра и обеспечивали изотропное разрешение, также без вращения образца.
Руководства по сборке высококачественных приборов для микроскопии плоскостного освещения, включая SiMView, MuVi-SPIM, IsoView и OpenSPIM с открытым исходным кодом, помогают стандартизировать системы. Кроме того, программное обеспечение и алгоритмы SPIM доступны из этих источников. Со временем LSFM, скорее всего, достигнет той же степени коммерческой доступности и стандартизации, которой пользуются другие методы микроскопии.
Селективная микроскопия плоскостного освещения iSPIM, diSPIM и SPIM triple view
Внедрение методов инвертированной селективной микроскопии плоскостного освещения (iSPIM) в лаборатории Хари Шроффа представило новый мощный подход в адаптации флуоресцентной микроскопии плоскостного освещения для широкого использования. Микроскоп для iSPIM состоит из «головки», к которой прикреплены осветительный и детектирующий объективы. Ориентация осветительных и детектирующих объективов "сверху" позволяет использовать более традиционные методы подготовки образцов (например, выращивание клеток на покровном стекле). Данный подход контрастирует с большинством методов флуоресцентной микроскопии плоскостного освещения, где образец должен быть окружен гелем и установлен между объективами нетрадиционным способом. «Головка» также содержит гальванометрические сканеры для перемещения «светового листа» и пьезоприводы для перемещения детектирующего объектива по оси Z, чтобы удержать «световой лист» в фокальной плоскости. «Головка» обеспечивает невероятно гибкое решение, которое можно установить практически на любом инвертированном микроскопе, что обеспечивает относительно простую интеграцию на существующие платформы.
Более продвинутый метод двойной инвертированной селективной микроскопии плоскостного освещения (diSPIM) представляет собой разумную адаптацию оригинального дизайна инвертированной селективной микроскопии плоскостного освещения. В данном подходе освещение и детектирование чередуются между обоими объективами, с последующей регистрацией и деконволюцией изображения, применяемыми для объединения дополнительных проекций и обеспечения изотропного оптического разрешения 330 x 330 x 330 нм. Поскольку образец остается неподвижным, то удалось достигнуть скорости захвата порядка 200 изображений в секунду, что позволяет исследователям получить полный z-стек менее, чем за секунду, что идеально подходит для регистрации динамики в живых системах в 3D. Выбор объектива для diSPIM (и большинства LSFM методов) ограничен пространственными помехами - близость осветительного и детектирующего объективов ограничивает применение больших объективов с высокой числовой апертурой и с соответственно короткими рабочими расстоянием. Это небольшая проблема diSPIM метода, поскольку используются два одинаковых объектива, тогда как в других методах флуоресцентной микроскопии плоскостного освещения используется объективы с меньшим увеличением и числовой апертурой, с более длинными рабочими расстояниями в сочетании с более крупными детектирующими объективами с высокой числовой апертурой. В настоящее время diSPIM микроскопия и связанные с ней методы наиболее часто применяются с использованием пары объективов Nikon Apo 40x 0.8 NA для погружения в воду (с рабочим расстоянием 3.5 мм).

Рис. 6 Иллюстрация головки для diSPIM, установленной на инвертированном микроскопе
Совсем недавно технология diSPIM была адаптирована для использования объектива, установленного в револьверной головке в обычном положении для инвертированного микроскопа, на котором установлена «головка» для diSPIM. Ранее в данном положении использовались объективы с малым увеличением и малой числовой апертурой, чтобы разместить образец, но не для сбора данных. Тем не менее, последняя итерация iSPIM микроскопии - triple view SPIM - использует объектив с высокой числовой апертурой, захватывая даже больший телесный угол излучения флуоресценции. Triple view SPIM была продемонстрирована с помощью иммерсионного объектива с числовой апертурой 1.2 в револьверной головке микроскопа, что улучшило оптическое разрешение этой установки до 235 x 235 x 324 нм и повысило уровень сигнала. Однако, поскольку объектив в револьверной головке находится под углом 45° к «световому листу» (от любого объектива diSPIM головки) он должен перемещаться вдоль оси z, чтобы регистрировать флуоресценцию, генерируемую в фокусе световым "листом" по всему углу. Это оптимизируется путем синхронизации сканирования вдоль оси z с движением скользящего затвора камеры sCMOS в оптическом пути пути формирования объектива в револьверной головке.
Флуоресцентная микроскопия плоскостного освещения с одним объективом
В дополнение к инвертированной селективной микроскопии плоскостного освещения iSPIM и связанных с ней методов существует несколько модульных конструкций с одним объективом для флуоресцентной микроскопии плоскостного освещения, предназначенных для того, чтобы сделать метод доступнее для неспециалистов и для интеграции на существующие платформы для микроскопов. Одна такая конструкция, называемая OCPI (микроскоп с планарным освещением в фокальной плоскости), представляет собой модульный блок, в котором осветительный и детектирующий объективы жестко связаны, смонтированы вместе на общем держателе и отъюстированы.
Многие подходы флуоресцентной микроскопии плоскостного освещения используют альтернативные стратегии освещения, чтобы упростить использование иммерсионных объективов с высокой числовой апертурой. Некоторые используют наклонное освещение, аналогичное тому, которое реализуется при работе c флуоресцентной микроскопией полного внутреннего отражения (TIRF) с освещением, не достигающим критических значений. Эти методы, которые называются HILO и OPM, обеспечивают преимущества плоскостного освещения, но с меньшими полями зрения. Наклонное освещение создает небольшой стационарный «световой лист», которым можно сканировать образец, используя транслятор с пьезо приводом для получения объемного изображения. Однако из-за наклонного освещения требуется исправлять угловое поле в плоскости изображений в некоторой точке вдоль оптической оси. Это достигается путем проецирования изображения для детектирования вторым объективом, который расположен под углом, корректирующим наклонную геометрию, как показано на рисунке 6 ниже. Выравнивание объектива должно быть почти идеальным, чтобы моделировать плоское поле.
OCPI метод был продемонстрирован с использованием объектива с 60-кратным увеличением и числовой апертурой 1.35. Однако одним из недостатков этого подхода является ограниченный размер поля, что исключает его использование для больших образцов (например, моделей эмбрионов). Кроме того, полная числовая апертура объектива для визуализации не может быть использована, так как при восстановлении плоскости образца используются объективы с меньший числовой апертурой, ограничивая этот метод до числовой апертуры меньше 1 на практике. Эти стратегии не сосредоточены на улучшении разрешения, они скорее оптимизируют условия работы с методом флуоресцентной микроскопии плоскостного освещения, помогая упростить требования к конструкции для исследователей, стремящихся создать свои собственные инструменты для анализа небольших биологических образцов, таких как отдельные клетки.
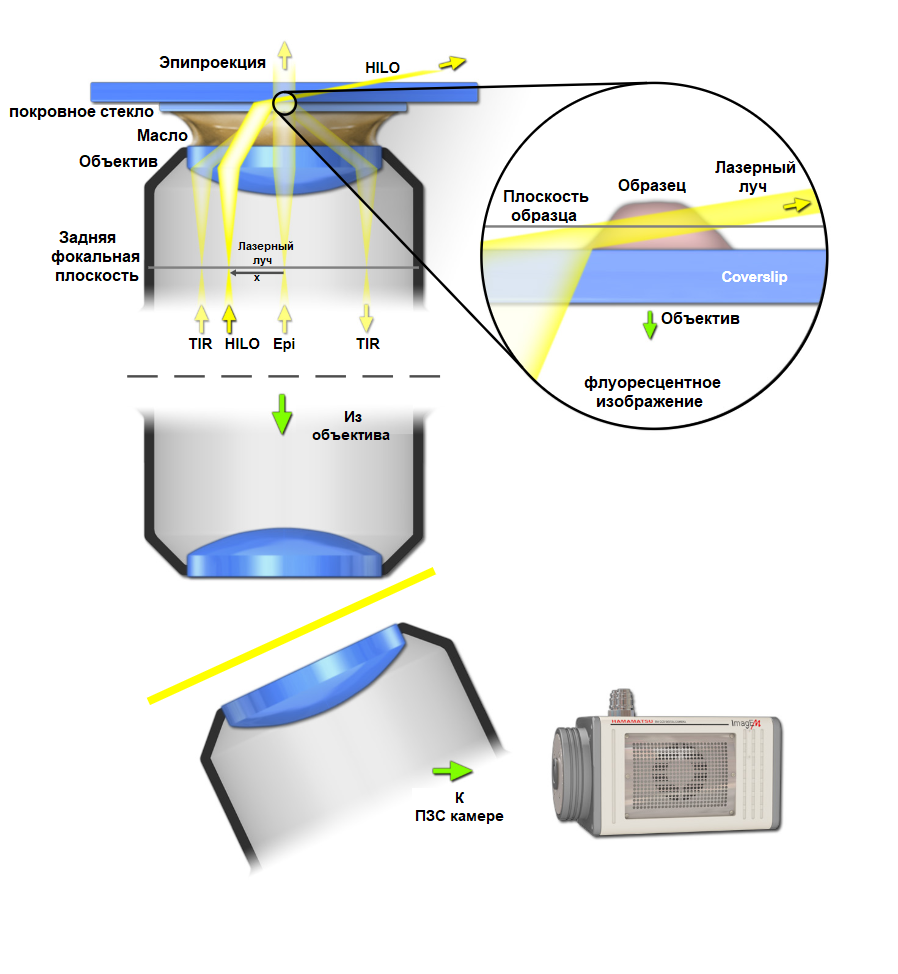
Рис. 7 HILO освещение и детектирование наклонной плоскости
Световой путь в микроскопии с наклонной плоскостью (OPM). Проиллюстрированы углы, необходимые для достижения TIRF, HILO и типичного эпископического освещения. Наклонное освещение позволяет селективно возбуждать тонкую плоскость в образце, однако эта плоскость наклонена. OPM корректирует угол освещения, проецируя изображение для обнаружения вторым объективом под совпадающим углом, с последующим обнаружением системой камер.
Вторая стратегия заключается в использовании углового зеркала или специализированной призмы, соединенной с объективом, проецирующим «световой лист» непосредственно в образец. В одном подходе используется удаляемое зеркало на кантилевере, как в атомно-силовой микроскопии. Зеркало расположено рядом с детектирующим объективом, чтобы отражать «световой лист» в образце. Изображение по оси Z достигается за счет вертикального перемещения образца, при этом освещение остается постоянным, чтобы не нарушать выравнивание системы. Как и в случае с наклонным освещением, этот метод имеет ограниченный размер поля по сравнению с другими методами флуоресцентной микроскопии плоскостного освещения, как правило, с размером перетяжки около 1 мкм и конфокальным параметром 10 мкм. Кроме того, существуют проблемы со сложностью реализации, а также с общей оптической стабильностью такой установки. Недавний вариант этого метода был направлен на решение этих проблем путем замены зеркала на призму Пеллина-Брока, на которую непосредственно помещается образец. Свет направляется через угловую призму и становится «световым листом» в образце. Хотя метод был продемонстрирован только на апикальной мембране адгезивных клеток, этот подход является многообещающим, предлагая достаточно высокое отношение сигнал-шум и разрешение для проведения экспериментов по отслеживанию отдельных частиц.
Супер-разрешение с флуоресцентной микроскопией плоскостного освещения
Существует множество альтернативных способов получения изображений со сверхразрешением за пределами дифракционного предела с помощью флуоресцентной микроскопии плоскостного освещения. Отслеживание и локализация отдельных молекул в сочетании с флуоресцентной микроскопией плоскостного освещения становится довольно распространенным методом. Один такой подход, названный селективная микроскопия плоскостного освещения для локализации отдельных молекул (IML-SPIM), сочетает в себе плоскостное освещение с микроскопией для локализации одной молекулы (SMLM). Мощный «световой лист» используется для того, чтобы вызвать фотопереключение подходящих зондов, отдельные акты излучения хорошо разделены в пространстве и времени, что позволяет идентифицировать и ограничить субдифракционную локализацию отдельных флуорофоров. При наличии подходящего времени сбора данных можно создать реконструкцию с суперразрешением, сопоставив все локализации в одной плоскости.
Комбинируя флуоресцентную микроскопию плоскостного освещения с микроскопией плоскостного освещения для локализации одной молекулы, оптические изображения сверхвысокого разрешения могут быть получены из образцов с толщинами на порядки больше, чем обычно реализуются с использованием инструментов, не относящихся к флуоресцентной микроскопии плоскостного освещения (например, флуоресцентной микроскопией полного внутреннего отражения). В частности, IML-SPIM была продемонстрирована на ядерных меченых клеточных сфероидах толщиной более 100 мкм, локализующих белки гистонов, меченных фотоактивируемым флуоресцентным белком PAmCherry1. Субдифракционная осевая локализация отдельных флуорофоров в «световом листе» достигается путем введения астигматизма в функцию рассеяния точки через слабую цилиндрическую линзу. Локализации выглядят растянутыми в направлении x или y, в зависимости от точного осевого положения. Точность локализации составляет 35 нм в боковом направлении и 65 нм в осевом. Двухфотонная активация зондов в микроскопии для локализации одной молекулы в конфигурации IML-SPIM дополнительно ограничивает флуоресценцию в осевых направлениях, упрощая идентификацию одной молекулы и смягчая вредные эффекты рассеивающих сред.
Распространенный подход к повышению разрешения включает в себя комбинирование флуоресцентной микроскопии плоскостного освещения с микроскопией некогерентного структурированного освещения (SIM), называемой SPIM-SI. Микроскопия структурированного освещения использует симметричные, периодические шаблоны освещения, спроецированные в пространство изображений, чтобы отличить сфокусированную флуоресценцию от несфокусированной. На объекты вне фокуса не влияет пространственная модуляция шаблонов, что позволяет идентифицировать и отклонять их вклад. Для создания структурированного освещения в микроскопии, создается шаблон в виде синусоидально изменяющейся полосы чередующихся максимумов и минимумов, как правило, путем модуляции интенсивности освещения с помощью акустооптического перестраиваемого фильтра. Этот подход не следует путать с структурированным освещением сверхвысокого разрешения, которое использует интерференцию лучей для генерации дифракционно-ограниченной картины.
Связанный метод, известный как микроскопия HiLo (не путать с HILO: высоко наклонной и многослойной оптической микроскопией плоскостного освещения), также может использоваться для эффективного выделения несфокусированной информации. HiLo аналогичен микроскопии структурированного освещения, только требует двух изображений: одно изображение со структурированной подсветкой и одно обычное широкоформатное изображение. Структурированный шаблон освещения используется для идентификации низкочастотной несфокусированной информации, в то время как обычное широкополосное изображение содержит детали высокой пространственной частоты, которые могут быть потеряны при применении изображения освещения.
Также возможно комбинировать флуоресцентную микроскопию плоскостного освещения со STED микроскопия. Микроскопия на основе подавления спонтанного испускания — это метод точечного сканирования конфокального типа, основанный на высокомощном «истощающем лазере», который приводит возбужденные флуорофоры в основное состояние без флуоресцентного излучения, используя процесс стимулированного излучения. «Истощающий лазер» «оборачивается» обычным возбуждающим лучом, стимулируя излучение от возбужденных флуорофоров, находящихся вдали от центра возбуждающего луча, нелинейным образом. Таким образом, сверхразрешение достигается пространственным ограничением области, в которой зонды могут флуоресцировать, областью, ограниченной субдифракцией, причем размер этой области обратно пропорционален мощности «истощающего лазера». Применительно к флуоресцентной микроскопии плоскостного освещения «истощающий лазер» формируется в виде двойного «светового листа», который является возбудителем, и эффективно уменьшает размер перетяжки луча. В результате сообщается о ~ 30% увеличении как осевого, так и бокового разрешения по сравнению со стандартными методами визуализации флуоресцентной микроскопии плоскостного освещения. Обратите внимание, что соответствующий метод RESOLFT был аналогичным образом применен к флуоресцентной микроскопии плоскостного освещения для улучшения осевого разрешения.
Другие способы реализации флуоресцентной микроскопии плоскостного освещения
Некоторые дополнения к флуоресцентной микроскопии плоскостного освещения включают адаптивную оптику (AO). Адаптивная оптика уменьшает искажения волнового фронта, возникающие в результате обычных аберраций, вызванных образцом, в оптической микроскопии с помощью датчиков волнового фронта в сочетании с компонентами, которые компенсируют искажения, чаще всего это деформируемые зеркала (DM). Это позволяет выполнять коррекцию волнового фронта в ответ на аберрации образца, увеличивать разрешение и учитывать неоднородности в среде визуализации. Данные проблемы флуоресцентной микроскопии плоскостного освещения актуальны для глубоких полей зрения, где присутствуют рассеивающие и поглощающие факторы. Адаптивная оптика может быть реализована разными методами. Для флуоресцентной микроскопии плоскостного освещения характерной особенностью является то, что технически методы адаптивной оптики могут применяться независимо как для системы освещения, так для системы детектирования. Адаптивная оптика использовалась в флуоресцентной микроскопии плоскостного освещения для обеспечения возможности визуализации, используя стеклянный капилляр, компенсируя искажения, вызванные изменениями показателя преломления между стеклом и водной средой образца. В аналогичном подходе используется дифференциальная интерференционно-контрастная микроскопия (DIC) для оценки изменений показателя преломления в образцах, что позволяет проводить деконволюцию в пространстве.
Разработано несколько реализаций флуоресцентной микроскопии плоскостного освещения, в которых используется многомодовое оптическое волокно для проецирования «светового листа» вместо обычного осветительного объектива с линзами. Такие подходы имеют невероятно малую площадь. Они идеально подходят для лабораторий с ограниченным пространством, а также для тех кто заинтересован в потенциальном применении флуоресцентной микроскопии плоскостного освещения с эндоскопом.
Аппаратные средства флуоресцентной микроскопии плоскостного освещения
Построение системы для флуоресцентной микроскопии плоскостного освещения может быть трудным, потому что оно очень сильно отличается от традиционных конструкций микроскопов. На рисунке 7 представлена иллюстрация оптического пути в типичном приборе для селективной микроскопии плоскостного освещения с открытым источником двойного освещения.
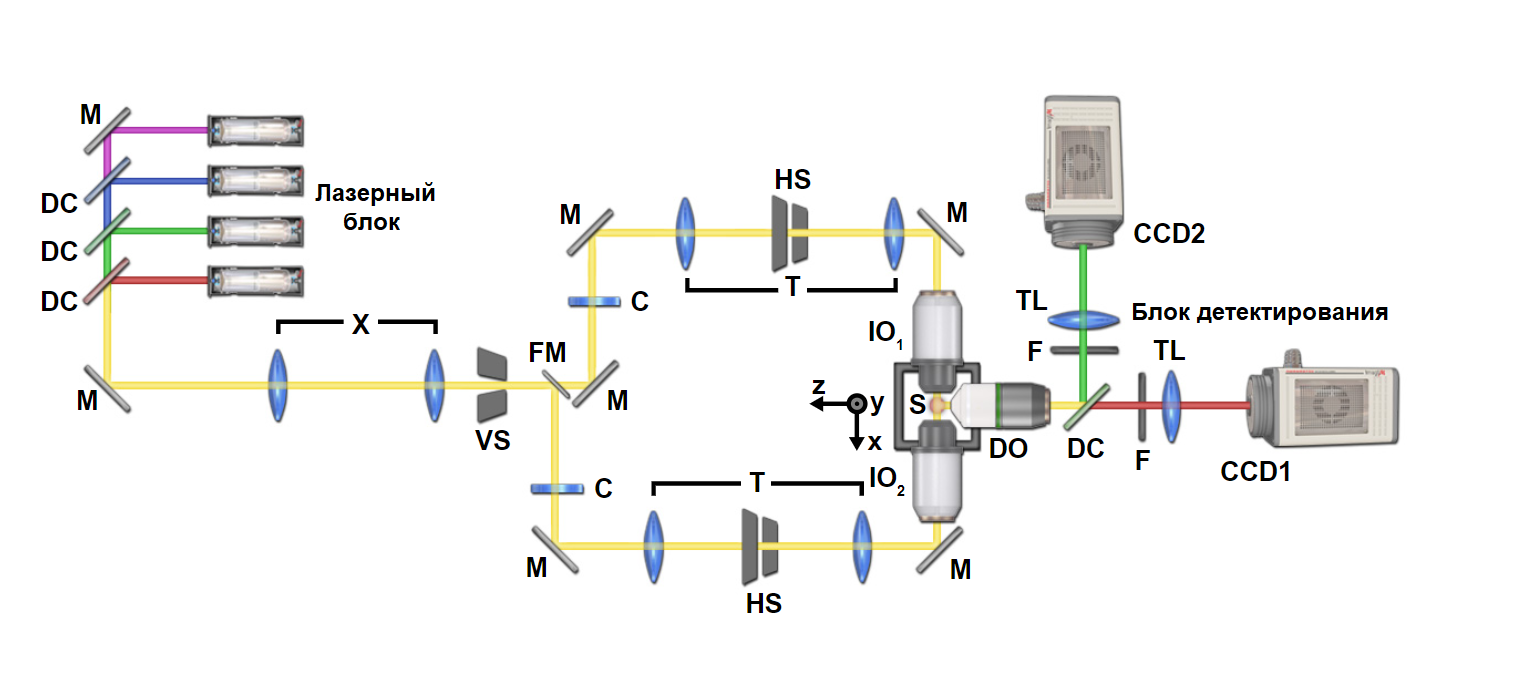
Рис. 8 Двойная оптическая подсветка в флуоресцентной микроскопии плоскостного освещения
Типичная оптическая система для селективной микроскопии плоскостного освещения с двойной подсветкой. «M» обозначает зеркала, «DC» - дихроичные зеркала, «X» - оптику телескопа, расширяющего луч, «VS» - вертикальную щелевую диафрагму для контроля толщины (числовой апертуры) «светового листа», «FM» - откидное зеркало, которое повернуто, чтобы направить свет вниз по направлению к IO1 или IO2 (Осветительные объективы), «C» - цилиндрическая линза для формирования луча в гиперболической плоскости, «T» - второй телескопический набор оптики, включающий в себя диафрагму с горизонтальной щелью «HS» для управления распространения «светового листа». Свет направляется на один из двух «IO» осветительных объективов, чтобы осветить образец «S». Детектирующий объектив «DO» направляет излучение света на дихроичное зеркало, которое разделяет излучение на один из двух путей детектирования. Каждый путь детектирования включает в себя излучающий фильтр «F» и трубчатый объектив «TL» для направления света в камеру «CCD1 / 2». Обратите внимание, как излучение разделяется на два канала с использованием соответствующих дихроичных фильтров расщепления луча для одновременного многоцветного детектирования.
Возможно, наиболее важным компонентом любой системы визуализации является камера. Использование устройств с зарядовой связью (ПЗС) считается промышленным стандартом для большинства приложений биологической визуализации. Кроме того, использование высокочувствительных (и дорогостоящих) ПЗС-матриц с умножением электронов (EMCCD) является популярным для многих современных приложений визуализации, требующих чувствительности на уровне одной молекулы. Однако более удачный выбор для современной флуоресцентной микроскопии плоскостного освещения — это научные камеры sCMOS с добавочными металлоксид-сверхпроводниками. Основными преимуществами камер sCMOS являются высокая скорость формирования изображения (до 100 Гц для полного поля зрения), умеренная стоимость и намного больший размер чипа по сравнению с ПЗС и EMCCD, что отлично подходит для формирования изображения в широком поле зрения. Высокая скорость получения изображений жизненно важна для полной реализации потенциала флуоресцентной микроскопии плоскостного освещения, особенно для объемной визуализации in vivo, когда важные события происходят в трех измерениях очень быстро. Для очень больших образцов размер микросхемы может иметь значение. Чтобы изобразить весь образец необходимо прибегнуть к альтернативной стратегии, такой как сшивание изображения. Все более распространенный подход использует сдвигаемый затвор камеры sCMOS в качестве конфокальной щелевой диафрагмы для цифровой сканирующей лазерной микроскопии плоскостного освещения с линейным сканированием, обеспечивая улучшение осевого разрешения, аналогично существующим конфокальным системам с линейным сканированием. Также возможно просто включить конфокальную диафрагму с прорезью для отклонения света вне фокуса вместо того, чтобы использовать сдвигаемый затвор.
Объективы
При выборе объектива для флуоресцентной микроскопии плоскостного освещения необходимо учитывать ряд различных факторов. Основными среди них являются характеристики образца и тип микроскопа плоскостного освещения. Размер образца определяет оптимальное поле зрения, рабочее расстояние и глубину резкости. Кроме того, оптическая конструкция микроскопа для флуоресцентной микроскопии плоскостного освещения накладывает множество внутренних пространственных ограничений на выбор объектива, о которых пользователь должен знать при разработке эксперимента.
В большинстве случаев объективы с коротким рабочим расстоянием имеют сложности с расположением в пространстве, так как два объектива должны быть перпендикулярны друг у другу и находиться очень близко. Большинство иммерсионных объективов с высокой числовой апертурой (NA> ~ 1.1) попадают в эту категорию. Кроме того, масляная иммерсия обычно не очень хорошо подходит для флуоресцентной микроскопии плоскостного освещения, так как большинство образцов большие или помещены либо в водную или культуральную среду, либо в агарозный гель. В таких случаях получают оптимальное изображение с использованием водно-иммерсионного объектива. Хотя несоответствие показателя преломления между объективом и образцом среды обычно не вызывает проблем с очень тонкими образцами (например, слипшимися ячейками на покровном стекле), а с образцами, показывающими пренебрежимо малую трехмерную структуру, сферическая аберрация быстро становится главной проблемой.
Как правило, детектирующими объективами для флуоресцентной микроскопии плоскостного освещения являются объективы с малыми и средними числовыми апертурами NA (~ 0,2-1,1). Для обычных или иммерсионных объективов с большими рабочими расстояниями и крутыми углами подхода (объективы для электрофизиологии хороший вариант). Идеальные характеристики зависят от интересующего образца. Конфокальные и смежные методы с высоким разрешением часто используют масляные иммерсионные объективы с высокой числовой апертурой NA (~ 1,3 - 1,49), что обеспечивает по своей природе большее боковое разрешение. Однако до числовой апертуры NA = 0,8 флуоресцентная микроскопия плоскостного освещения обеспечивает превосходное оптическое разрешение в осевых направлениях по сравнению с конфокальным микроскопом, использующим объектив с той же числовой апертурой. В конечном счете, флуоресцентная микроскопия плоскостного освещения предназначена для быстрой скорости сбора данных и минимизации воздействия на образец, а не для максимального оптического разрешения, и, следовательно, не может быть оценены на основе только по числовой апертуре используемого объектива.
Осветительные оптические системы, как правило, включают в себя осветительный объектив с малой числовой апертурой NA = 0,1-0,3 и небольшим 2-10-кратным увеличением. Часто в комплект входит другая оптика для формирования луча и для придания «световому листу» нужных размеров в зависимости от конструкции системы. Такая оптика включает в себя цилиндрические линзы, щелевые диафрагмы и расширители луча, как показано на рисунке 7. Популярные объективы Nikon для флуоресцентной микроскопии плоскостного освещения CFI Apo 40XW NIR (NA = 0,8), CFI75 LWD 16XW (NA = 0,8), CFI75 Apo LWD 25XW (NA = 1,1) и CFI Plan Fluor 10XW (NA = 0,3).
Источники света
Источником света для флуоресцентной микроскопии плоскостного освещения почти всегда является лазерный луч либо в виде плоского «светового листа», либо в виде сканированного гауссова, бесселевого или эйри-луча. Для плоских «световых листов» сохраняется только около 5% интенсивности лазера благодаря оптике для формирования луча, по сравнению с интенсивностью около 95% в конфигурации с линейным сканированием. Для передового метода комбинирования флуоресцентной микроскопии плоскостного освещения и двухфотонного возбуждения (2PE), требуются более сложная аппаратура и высококачественный лазерный источник света.
Хотя ртутные и галогенные дуговые лампы светящие в широком спектре, в принципе, могут быть сформированы в виде плоских «световых листов», получающаяся в результате интенсивность, как правило, недостаточна. Светодиоды обеспечивают аналогично недостаточную интенсивность освещения, хотя для флуоресцентной микроскопии плоскостного освещения характерно включать красный светодиод для освещения проходящим светом, обеспечивая простой и относительно неинвазивный метод позиционирования образца до формирования изображения. Мы ожидаем, что это изменится, поскольку все более мощные и экономичные светодиоды продолжают появляться.
Анализ и хранение данных
Жизненно важный аспект для рассмотрения - анализ данных. Флуоресцентная микроскопия плоскостного освещения способна генерировать огромные объемы данных, часто до нескольких терабайт из одного эксперимента. Для этого необходимо установить устройство управления данными, прежде чем включать флуоресцентную микроскопию плоскостного освещения в оперативный режим. Передача на компьютер или кластер для анализа и последующий рабочий процесс архивирования имеют первостепенное значение, и такие методы, как сжатие изображений, являются обязательными. Многие учреждения пользуются доступом к суперкомпьютерным ресурсам, ускоряя анализ. Непрерывное развитие услуг облачных вычислений также может оказаться полезным для хранения данных. Вычислительно эффективные и хорошо проверенные алгоритмы регистрации и анализа изображений с открытым исходным кодом доступны для анализа и обработки изображений в реальном времени.
Подготовка образцов для флуоресцентной микроскопии плоскостного освещения
Как указано, основное преимущество флуоресцентной микроскопии плоскостного освещения заключается в том, что для визуализации биологических образцов используются более традиционные методы флуоресценции, такие как конфокальная микроскопия. Флуоресцентная микроскопия плоскостного освещения также полезна для быстрой трехмерной визуализации клеточных культур с малой дозировкой света. Методы сканирования конфокальных точек не могут проникать в образец вдоль оптической оси более чем приблизительно на 700 микрометров, и это считается очень много. Обычно ухудшение изображения легко наблюдается на глубинах менее 100 микрометров. Флуоресцентная микроскопия плоскостного освещения в конечном итоге способна получать изображения на глубинах в десятки миллиметров, что сопоставимо только с многофотонной микроскопией в этом отношении. Хотя многофотонный метод все еще предпочтителен для визуализации очень крупных живых образцов (например, зрелых грызунов), флуоресцентная микроскопия плоскостного освещения лучше подходит для визуализации эмбриогенеза и раннего развития большинства моделей организмов. Популярные модели организмов для флуоресцентной микроскопии плоскостного освещения включают плодовых мух, рыбок данио, нематод и многое другое.
Подготовка образцов
Подготовка образца для флуоресцентной микроскопии плоскостного освещения часто трудна. С одной стороны, подготовка образцов может быть относительно простой для таких методов, как инвертированная селективная микроскопия плоскостного освещения и метод структурированного освещения, где образцы часто представляют собой прилипшие клетки, выращенные на покровных стеклах. Подготовка 2D адгезивных клеточных культур не будет обсуждаться, так как она очень распространена. С другой стороны, для получения изображений для селективной микроскопии плоскостного освещения более крупных и более сложных систем моделей требуются нестандартные методы подготовки образцов. Такие образцы включают в себя культивируемые трехмерные клеточные сфероиды или кисты, более мелкие модели организмов (например, эмбрионы дрозофилы, рыбок данио, медака и Xenopus) и эксплантированные ткани и органы. Существует два основных подхода к подготовке проб для флуоресцентной микроскопии плоскостного освещения. В первом используются специализированные реагенты для оптической очистки и кальциевые хелаторы, чтобы сделать оптически проницаемыми обычно непрозрачные структуры, что позволяет им беспрепятственно отображать структуры бони, такие как улитка внутреннего уха. Во втором подходе используются неочищенные образцы, обычно модели зародышей или сфероиды объемом не более кубического миллиметра, установленные в агарозном цилиндре с низкой температурой плавления для вставки в специализированную камеру для получения изображений.
Когда Арне Вой и его коллеги впервые представили флуоресцентную микроскопию с оптическими сечениями в ортогональной плоскости в 1993 году, они использовали раствор Spalteholz для очистки, который состоит из 5 частей метилсалицилата на 3 части бензилбензоата и имеет показатель преломления примерно 1.47, аналогичный показателю большинства белков. Таким образом, весь объем изображения соответствует показателю преломления, что делает его оптически прозрачным за счет значительного уменьшения рассеивающих помех. Однако очистка Spalteholz не учитывает кости или другие кальцифицированные ткани. Кальций сильно рассеивает свет. Таким образом, предварительное применение 10% хелатора кальция, такого как дегидрата этилендиаминтетрауксусной кислоты (ЭДТА) в dH2O, необходимо перед погружением в раствор Spalteholz. Имейте в виду, что такие жесткие протоколы подготовки образцов предназначены для фиксированной визуализации образцов. В случае с Войем и коллегами вырезанная, декальцинированная и оптически очищенная улитка была визуализирована томографически и подвергнута анализу методом конечных элементов для определения относительно крупных признаков. В настоящее время существует несколько альтернатив для раствора Spalteholz, которые можно изучить, такие как CLARITY, DISCO и связанные методы. Кроме того, использование очищенных образцов предоставляет уникальную возможность для использования объективов с более высокой числовой апертурой NA, поскольку многие изготовители микроскопов производят объективы с регулировочным кольцом для измерения показателя преломления специально для сопоставления показателя преломления объектива с показателем преломления очищенного образца.
Как уже говорилось, распространенным методом подготовки образца для флуоресцентной микроскопии плоскостного освещения является погружение образца в агарозный цилиндр, который действует как механически стабилизированная вода. В противном случае, образцы могут быть аналогичным образом встроены в гельрит, галактан, желатин, агар, альгинат или каррагинан. Чаще всего выбирают 0,8-1,0% Агарозы с низкой температурой плавления в воде или в натрий-фосфатном буфере (PBS). Важно отметить, что этот подход совместим с живыми образцами, и в настоящее время широко распространены изображения многих естественных прозрачных моделей организмов in vivo. Сначала следует приготовить гелеобразующий агент и дать ему остыть до температуры чуть выше температуры гелеобразования. Это может быть выполнено на горячей плите или на горячей водяной бане, как правило, лучше всего убедиться, что температура агента близка к 37 ° C непосредственно перед использованием (физиологическая температура для систем млекопитающих). В этот момент образец готов к установке, установка должна быть выполнено быстро, чтобы не вводить пузырьки в гель и избежать преждевременной полимеризации геля. После установки образцы должны быть немедленно отображены.
Встраивание чаще всего достигается путем формирования агарозы в цилиндрической камере, в которой может быть подвешен образец. Проще говоря, расплавленная агароза втягивается в шприц, где верхняя часть была удален. Затем образец может быть помещен в гель, который впоследствии полимеризуется, так что цилиндр можно вытолкнуть с помощью поршня. Рисунок 8 иллюстрирует этот метод, который может быть адаптирован для небольших образцов с использованием стеклянного капилляра (с поршнем) вместо шприца. Как правило, ширина образца должна составлять 1/3-2/3 диаметра агарозного цилиндра и располагаться как можно ближе к поверхности, обращенной к детектирующему объективу, чтобы минимизировать аберрацию. Кроме того, встроенные образцы не должны визуализироваться внутри капилляра или шприца из-за изменения показателя преломления.
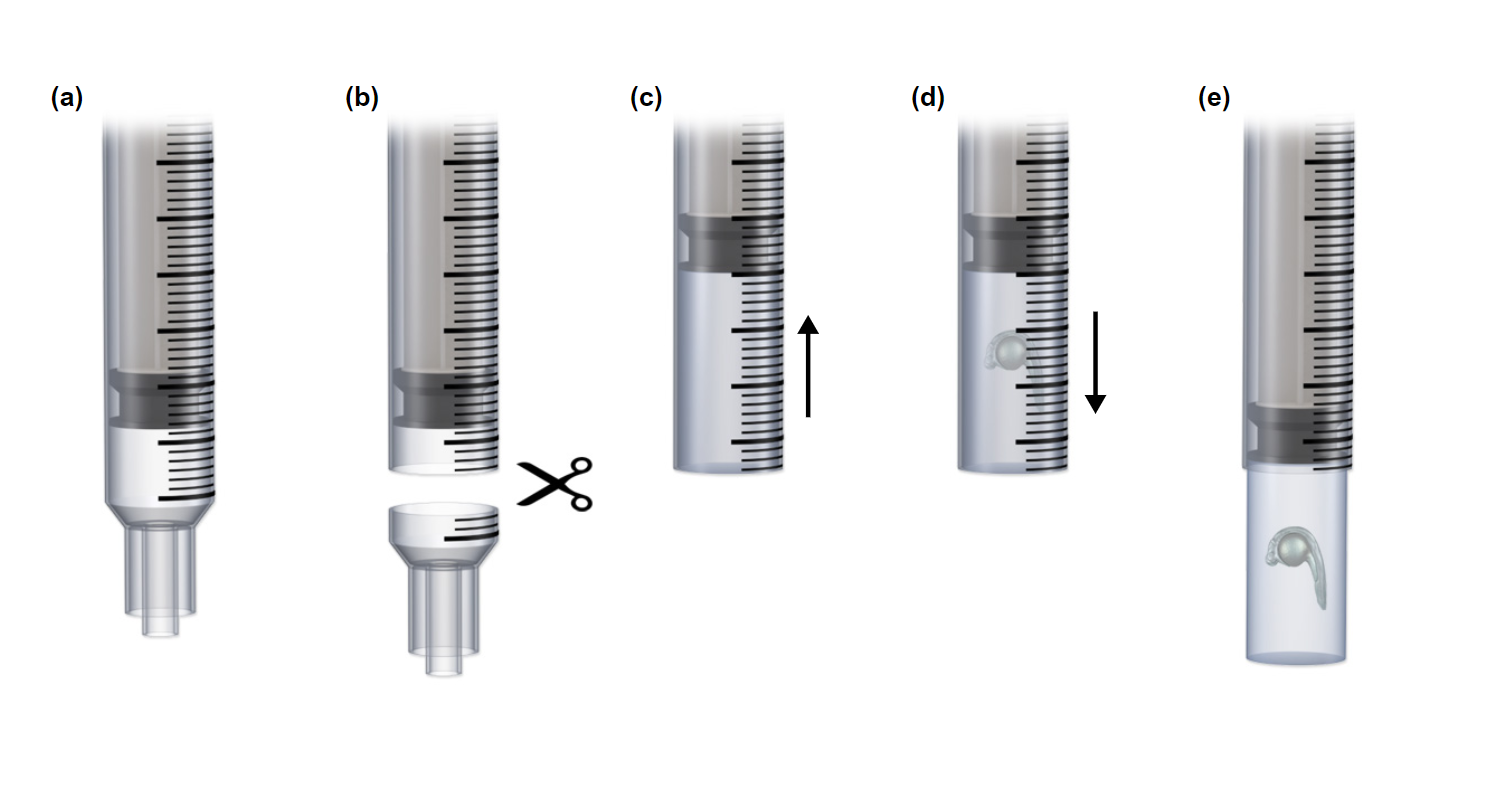
Рисунок 9 Подготовка образцов для флуоресцентной микроскопии плоскостного освещения
Встраивание Агарозы для визуализации «световых листов». (а) обычный пластиковый шприц. (b) кончик шприца отрезан для большего доступа. (c) расплавленная агароза втягивается в корпус шприца. Теперь должен быть вставлен образец. (d) полимеризация агарозы с внедренным образцом. (е) выдавливание агарозного цилиндра для визуализации.
Существует два основных метода встраивания агарозы. Наиболее простым является смешивание образца с агарозой непосредственно перед закачкой в шприц или капилляр для полимеризации. Этот метод хорошо работает для небольших образцов, таких как флуоресцентные шарики, клеточные сфероиды и кисты, дрожжи и даже маленькие эмбрионы. Однако для более крупных образцов, таких как развивающиеся модели организмов, заливочную форму сначала заполняют агарозой, а затем образец осторожно помещают внутрь перед полимеризацией. Это позволяет лучше контролировать выравнивание образцов по сравнению с первым методом. Точно так же для особо сложных образцов агарозный цилиндр может быть сформирован отдельно, в него может быть выполнено отверстие или прорезь, образец помещен в него и свежая расплавленная агароза залита для покрытия образца. Наконец, для образцов, которые не должны быть встроены, внутри цилиндра может быть построена камера для хранения натрий-фосфатного буфера или питательной среды и впоследствии герметизирована с использованием большего количества агарозы. Эта внутренняя камера может быть отформована путем прикрепления твердого цилиндра к кончику поршня, что позволяет агарозе полимеризоваться вокруг него. Обратите внимание, что для этого подхода следует использовать более высокую концентрацию агарозы (~ 1,5%), чтобы обеспечить механическую стабильность тонких стенок камеры.
Альтернативные способы крепления образца очень распространены. Образцы могут быть закреплены на изогнутом стеклянном капилляре, который можно вращать или перемещать по мере необходимости для визуализации. Другая распространенная практика - приклеивать образец к стержню или капилляру или оставлять его частично выдавленным из шприца. Специализированные камеры для съемки флуоресцентной микроскопии плоскостного освещения привлекают больше внимания. В одном многообещающем подходе используются трехмерные принтеры для создания нестандартных держателей из материалов на выбор.
Применение флуоресцентной микроскопии плоскостного освещения
Как указывалось ранее, флуоресцентная микроскопия плоскостного освещения способствует визуализации больших образцов длиной до десятков миллиметров. Обычные образцы включают в себя анатомические структуры и эксплантированные ткани, такие как мозг мыши, компоненты улитки мыши, морской свинки, среднего и внутреннего уха, и многое другое. Модели организмов для флуоресцентной микроскопии плоскостного освещения включают в себя обыкновенную плодовую мушку Drosophila melanogaster, рыбу-данио Danio rerio, рыбу-медаку Oryzias latipes, нематоду Caenorhabditis elegans, мошку Chironomus tentans, африканского головастика Xenopus laevis и небольшое цветущее растение Arabidopsis thha. Эти организмы обычно визуализируются на эмбриональной стадии, но визуализация всего взрослого организма была выполнена для многих из перечисленных видов.
Ранние реализации флуоресцентной микроскопии плоскостного освещения, в частности флуоресцентной микроскопии с оптическими сечениями в ортогональной плоскости, были сосредоточены на исследованиях слуха путем визуализации структуры компонентов среднего и внутреннего уха. В ранних исследованиях использовались «толстые световые листы» толщиной около 20-30 микрометров, что давало очень большие поля зрения длиной в несколько миллиметров. Обрезанные, оптически очищенные улитки морской свинки и барабанная перепонка были одними из первых образцов, которые были получены с помощью флуоресцентной микроскопии с оптическими сечениями в ортогональной плоскости. Эти изображения позволили провести революционную трехмерную реконструкцию и картирование этих структур. Позднее будет выполнена визуализация и моделирование барабанной перепонки морской свинки с использованием аналогичной методики с разрешением около 16 микрометров. Использование «тонких световых листов» с боковым сканированием (HR-OPFOS) позволило добиться гораздо большего оптического разрешения (~ 2,0 микрометра) в полях диаметром 30 мм или более, что позволило получить еще лучшие изображения улитки и других структур ушей.
Возможно, самое популярное применение флуоресцентной микроскопии плоскостного освещения — это отслеживания эмбриогенеза. Первым таким примером была визуализация эмбриогенеза дрозофилы, меченной с использованием EGFP (усиленным зеленым флуоресцентным белком), слитой с мезином для визуализации плазматических мембран. С тех пор эмбриогенез стал основной мишенью для визуализации с помощью флуоресцентной микроскопии плоскостного освещения, при этом большинство исследователей решили использовать генетически экспрессируемые ядерные маркеры либо гистоны с усиленным зеленым флуоресцентным белком либо экзогенно индуцированные, как при окрашивании ядер Hoescht 33342. Это позволило провести комплексное отслеживание клеточной линии и отслеживание развития эмбрионов. На рисунке 9 представлены изображения эмбриогенеза мыши, полученные цифровой сканирующей лазерной микроскопией плоскостного освещения, отслеживающие различные срезы развивающегося эмбриона с течением времени и в 3D. Позже была реализована двухфотонная цифровая сканирующая лазерная микроскопия плоскостного освещения для проведения аналогичных экспериментов с использованием дрозофилы. Были проведены более узконаправленные исследования, например, выстраивание только клеток, участвующих в развитии боковой линии у рыбок данио. Используя современные вычислительные методы, было продемонстрировано полностью автоматизированное отслеживание клеток.
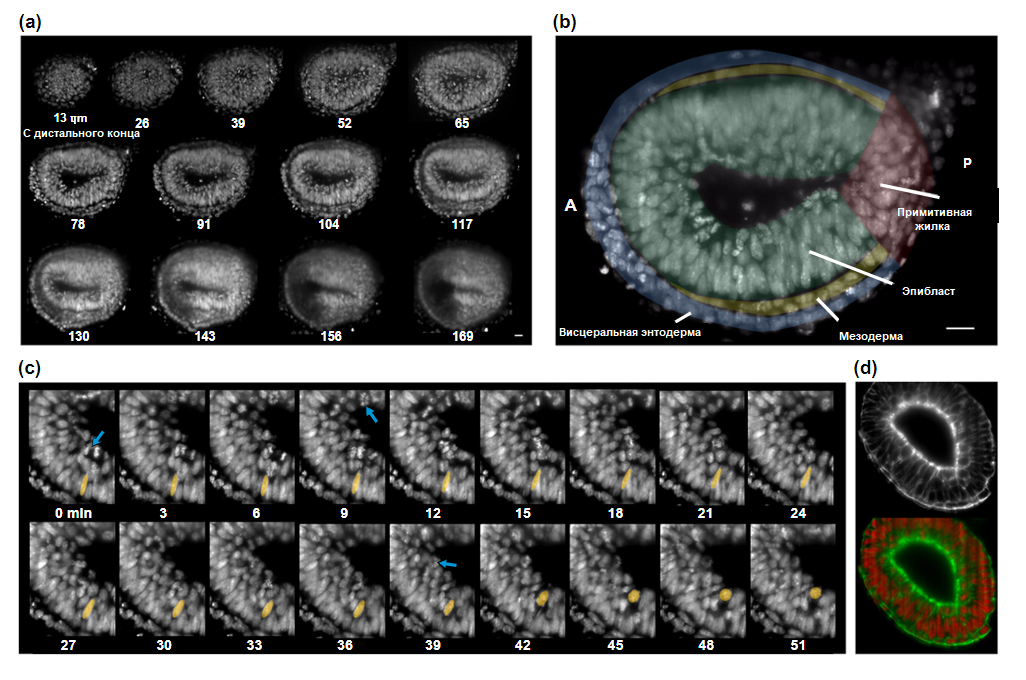
Рис. 10. Промежуточная 3D-визуализация эмбриогенеза мыши с использованием цифровой сканирующей лазерной микроскопии плоскостного освещения
Покадровая 3D-визуализация эмбриогенеза мыши с использованием цифровой сканирующей лазерной микроскопии плоскостного освещения (DSLM). (a) Серия изображения вдоль оси Z эмбриона мыши с гистоном H2B-GFP, каждое изображение представляет собой проекцию максимальной интенсивности стека толщиной 13 мкм и на расстоянии, обозначенного меткой, от дистального конца эмбриона. (b) Оптическое сечение эмбриона мыши H2B-GFP на расстоянии 78 мкм от дистального конца эмбриона, аннотированного для висцеральной энтодермы (синий), эпибласта (зеленый), мезодермы (желтый) и примитивной жилки (красный). Передний (A) слева, задний (P) справа. Масштаб = 20 мкм. (c) Разрешенные во времени интересующие области в эпибласте. Делящиеся ядра обозначены синими стрелками, а выделенное ядро (желтое) демонстрирует экспонирование интеркинетической ядерной миграции в апикальном направлении. (d) Изображение сечения, окрашенного фаллоидином Alexa Fluor 546 (F-актин, используемый в качестве мембранного маркера) на верхней панели и перекрытого DRAQ5 (ядро, красный) на нижней панели. Эта фигура была воссоздана в соответствии с условиями лицензии Creative Commons «Attribution» от: Ichikawa T, Nakazato K, Keller PJ, Kajiura-Kobayashi H, Stelzer EHK, Mochizuki A, et al. (2013) Живое изображение эмбрионов цельной мыши во время гаструляции: анализ миграции эпибласта и мезодермальных клеток. PLOS ONE 8 (7): e64506. DOI: 10.1371 / journal.pone.006450
Скорость и большое поле зрения, предоставляемые флуоресцентной микроскопией плоскостного освещения, оказались полезными для получения изображений кальция в живых образцах. Чувствительный к кальцию FRET-зонд Cameleon (YC3.6), который состоит из голубого и желтого флуоресцентного белка, связанного с чувствительным к кальцию калмодулиновым доменом, был использован для исследования динамики кальция в корнях арабидопсиса в ответ на внешние раздражители, такие как добавление АТФ (рисунок 10). В одном недавнем исследовании изменяющаяся во времени активность около 80% нейронной сети рыбок данио визуализировалась с использованием индикатора кальция GCaMP5G, обнаруживая тогда неизвестные корреляции в активности разрозненных частей мозга. Объектив, совмещённый с плоскостным освещением, был использован для визуализации динамики кальция в вомероназальных нейронах мыши, подвергшихся воздействию различных раздражителей. Самая первая флуоресцентная микроскопия плоскостного освещения с двухфотонным возбуждением была применена для кальциевой визуализации C. elegans с использованием Cameleon.
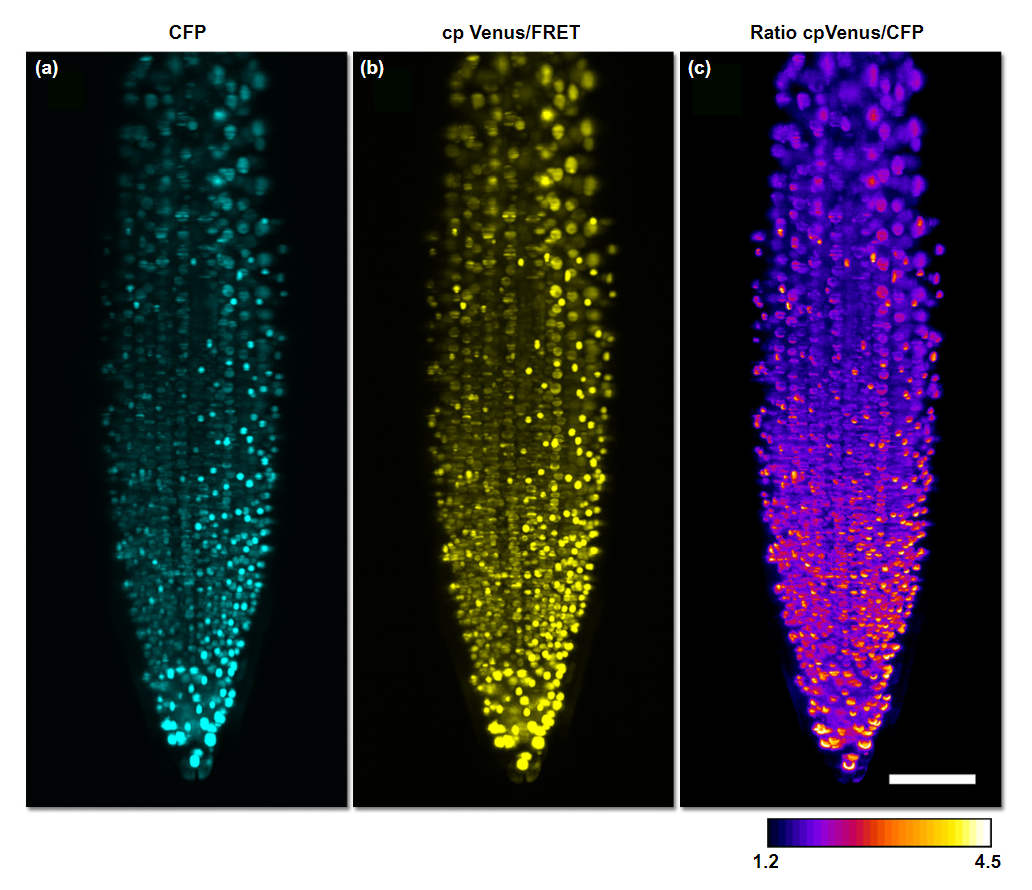
Рис. 11 - флуоресцентный резонансный перенос энергии кальция с использованием Cameleon в корнях A. thaliana
Динамика кальция, визуализированная с помощью флуоресцентной микроскопии плоскостного освещения в кончике корня Arabidopsis thaliana, с клетками, экспрессирующими локализованный в ядре Cameleon (YC3.6). (a) Канал донорской визуализации голубого флуоресцентного белка (CFP). (b) Канал визуализации акцептора флуоресцентного белка Венеры. (c)Изображение флуоресцентного резонансного переноса энергии, показывающее отношение Венеры к CFP, демонстрирующее наибольшую активность в направлении кончика корня. Масштаб = 50 мкм. Эта цифра воссоздана по лицензии Creative Commons «Attribution» от: Costa A, Candeo A, Fieramonti L, Valentini G, Bassi A (2013). Динамика кальция в корневых клетках Arabidopsis thaliana, визуализированная с помощью селективной микроскопии плоскостного освещения. PLOS ONE 8 (10): e75646. DOI: 10.1371 / journal.pone.0075646
Одно из самых ранних расширений флуоресцентной микроскопии плоскостного освещения было направлено на флуоресцентную корреляционную спектроскопию (FCS), метод, который коррелирует флуктуации интенсивности флуоресценции с изменениями концентрации флуорофора и другими физическими параметрами. Флуоресцентная корреляционная спектроскопия обычно используется для определения концентрации, синглет-триплетной динамики, коэффициентов диффузии и многого другого. Хотя чаще всего применяется в сочетании с конфокальной или многофотонной микроскопией, комбинация селективной микроскопии плоскостного освещения и флуоресцентной корреляционной спектроскопии (называемая SPIM-FCS) была использована для записи более 4000 спектров за минуту и с минимальным возбуждением образца. Конфокальные системы обычно требуют около минуты, чтобы собрать один спектр.
Другое интересное применение флуоресцентной микроскопии плоскостного освещения — это онтогенетический контроль биологических функций. Оптогенетика — это новая область, которая использует светочувствительные белки для контроля клеточных функций и, следовательно, поведения организма. Комбинируя каналродопсин-2, галородопсин и флуоресцентную микроскопию плоскостного освещения, Арренберг и его коллеги смогли осуществлять очень точный временной контроль над ионными каналами в клетках кардиостимулятора рыбок данио (кардиомиоциты). Цифровое микрозеркальное устройство (DMD) использовалось для создания произвольных структур освещения в трех измерениях с помощью оптической детектирующей системы, независимой от проецированного «светового листа», позволяющей активировать одну ячейку. Многие новые методы основаны на новых стратегиях освещения с помощью оптической детектирующей системы, независимой от формирования "светового листа". Этот оптогенетический подход позволил симулировать остановку сердца, тахикардию и многое другое.
Неинвазивная природа визуализации флуоресцентной микроскопии плоскостного освещения также оказалась полезной для экспериментов по отслеживанию одиночных частиц в трудных средах и на глубинах, проблематичных для большинства микроскопов. Отслеживание одной молекулы было продемонстрировано на глубине нескольких сотен микрометров в образце, где оптическое рассеяние и поглощение, как правило, исключают такие точные подходы, особенно с использованием более медленных методов, таких как конфокальное точечное сканирование.
Заключение
Флуоресцентная микроскопия плоскостного освещения (LSFM) переживает настоящий рассвет, и за последние несколько лет было изобретено и оптимизировано множество интересных методов. Несмотря на старую концепцию, LSFM включает в себя революционный набор методов, основанных на уходе от взаимозависимости оптических путей освещения и детектирования, что позволяет радикально сократить время объемной визуализации, фототоксичность / фотообесцвечивание и улучшить качества изображения больших флуоресцентно-маркированных образцов. Освещение "листом" света обеспечивает селективное возбуждение и детектирование структур в фокальной плоскости, что позволяет избежать ненужного облучения всего объема образца для регистрации флуоресценции от небольшой его части. Это особенно важно, поскольку экспериментальные требования смещаются в сторону количественного анализа изображений больших биологически значимых образцов (например, целых модельных организмов, тканей и трехмерных культур) с пренебрежимо малой трехмерной структурой. Кроме того, более тонкие образцы, такие как адгезивные клетки, значительно выигрывают от радикально уменьшенного воздействия света.
Микроскопия плоскостного освещения открыла ряд возможностей для быстрой и эффективной визуализации. Крупные (диаметром более 100 мкм) клеточные цисты и сфероиды представляют собой отличные трехмерные гомеостатические модельные системы, которые используются в приложениях лечения рака и открытия лекарств, поскольку их функции имитируют функции опухолей. LSFM предоставляет метод для долгосрочной и высокопроизводительной визуализации таких систем культивирования. Это еще более отчетливо проявляется при визуализации организмов, таких как рыбки данио и плодовых мух, что позволяет выполнять сложные приложения, такие как комплексная реконструкция клеточной линии и FRET, в целых развивающихся эмбрионах. LSFM также применим для структурной и томографической визуализации очень крупных структур органов, наиболее известной из которых является улитка внутреннего уха, и использовался для корреляционной визуализации с помощью известных томографических методов, таких как µCT. Методы LSFM представляют собой смену парадигмы, ответ на растущий спрос на улучшенные методы 3D-визуализации. Многие проблемы все еще существуют, особенно в области управления данными, но растущая популярность и полезность LSFM предвещают будущее этой техники.








