Традиционно культивирование живых клеток вне организма проводится в монослоях внутри статичных пластиковых колб с полимерным покрытием, помещенных в CO2-инкубаторы, в которых поддерживается высокий уровень влажности, постоянная температура (37 °C) и концентрация CO2 (5%) для буферизации pH. Чтобы облегчить анализ и избежать перекрестного загрязнения, в составе культур используются клетки одного типа. Культивирование клеток обеспечивает платформу для изучения клеточного поведения систематическим способом, с надлежащей изоляцией переменных и четким экспериментальным дизайном, позволяя проводить исследования, которые было бы не этично проводить на людях, при этом сокращая использование неаналогичных животных моделей. Более того, появление клеточных культур ответственно за исторические достижения в области биомедицины, такие как вакцина против полиомиелита, связь между вирусами и раком, возникновение области генной инженерии и т.д.

Тем не менее, это редукционистский подход, который не представляет внутреннюю сложность клеточной дифференцировки и взаимодействия, функции тканей, лекарственного ответа, а также динамичного и сложного микроокружения, присутствующего в биологии in vivo (рис. 1.). Эти физические и химические сигналы имеют решающее значение для клеточного развития и поведения, и их отсутствие приводит к плохой трансляции между системами in vitro и in vivo. Кроме того, традиционные протоколы клеточных культур требуют много времени и трудозатрат. Эти ограничения оказывают глубокое влияние на здравоохранение и фармацевтическую промышленность, приводя к неэффективным и все более дорогостоящим процессам разработки лекарств. По оценкам, около 40% новых лекарственных препаратов, которые проходят клинические испытания, терпят неудачу из-за непредвиденных токсических эффектов на людях. Устранение разрыва между доклиническими и клиническими данными требует более совершенных методов прогнозирования реакции на человека.
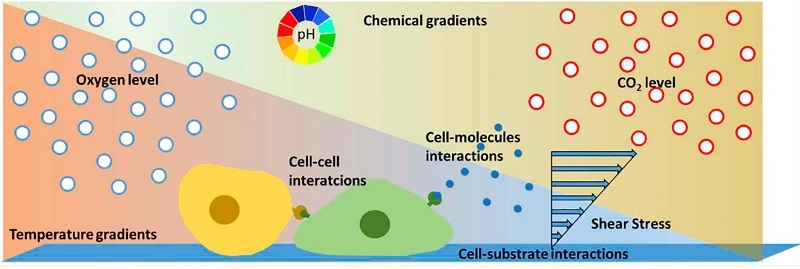
Рисунок 1. Иллюстрация сигналов в клеточном микроокружении. Химические и температурные градиенты, межклеточные взаимодействия, молекулярные сигналы от различных типов клеток и физические стимулы являются жизненно важными для развития и поведения клеток, которые слабо представлены в традиционном культивировании клеток.
Миниатюризация культивирования клеток в микрофлюидных системах может устранить некоторые из упомянутых недостатков, а также обеспечить другие интересные возможности. Малые объемы, с которыми работают в микрофлюидике, существенно снижают количество реагентов, необходимых для традиционной культуры клеток, что, помимо непосредственного снижения затрат, особенно выгодно при работе с ограниченными или редкими образцами, такими как первичные клетки пациентов (собранные непосредственно у пациентов в отличие от иммортализованных клеточных линий). Кроме того, работа с меньшим количеством клеток уменьшает гетерогенность культуры, поэтому сложное поведение клеток легче различить. Простота изготовления микрофлюидных устройств послужила основой для создания чипов, в которых могут быть воспроизведены ключевые аспекты клеточной микросреды, т.е. совместное культивирование различных типов клеток без перекрестного загрязнения, а также воспроизведение физических стимулов и химических градиентов с высокой пространственно-временной точностью благодаря управляемому пользователем потоку. Появление непрерывной или по требованию текучей среды поверх клеток представляет особый интерес, поскольку это не только воспроизводит динамическую среду человеческого организма, но и автоматизирует большую часть трудоемкой практики культивирования клеток. Это, в сочетании с высоким уровнем контроля, обеспечиваемым ламинарным потоком и предопределенной геометрией каналов, позволяет точно добавлять интересующие соединения или отбирать образцы микросреды без значительного нарушения жизнедеятельности клеток. Более того, высокая пропускная способность может быть достигнута путем параллельного использования нескольких микрофлюидных устройств, в которые можно интегрировать и непрерывно проводить мониторинг и анализ.
Преимущества микрофлюидного культивирования клеток, которая может легко имитировать клеточную микросреду и обеспечивать высокий уровень контроля в дополнение к автоматизированному мониторингу и анализу, привели к развитию в 2010-х годах области "орган-на-чипе" (ОНЧ), которая в настоящее время является одной из наиболее актуальных областей исследований в микрофлюидике. ОНЧ- это специализированные модели клеточных культур in vitro на основе микрофлюидных устройств, которые построены на трех основных принципах: воспроизведение механических и биохимических стимулов клеточного микроокружения; имитация трехмерной микроархитектуры тканей с несколькими типами клеток, размещенных в определенных коммуникативных компартментах; и воспроизведение функциональных интерфейсов "ткань-ткань" посредством взаимодействия клеток с клетками (рис. 2.a.). Основной целью является воспроизведение сложной биологии in vivo для лучшего понимания клеточного поведения и метаболизма, фенотипов заболеваний и реакции на лекарства без необходимости использования недостаточных моделей in vitro или неточных моделей животных.
Было успешно разработано несколько устройств "орган-на-чипе": печень, легкие, почка, сердце, кишечник, кость и костный мозг, нерв, кровеносные сосуды и гематоэнцефалический барьер (рис. 2.b.). По сравнению со стандартными моделями in vitro они продемонстрировали лекарственные реакции, более близкие к физиологии человека, а повышенная сложность привела к лучшей дифференцировке клеток и переносу лекарств. По мере развития моделей ОНЧ становится возможным соединение нескольких ОНЧ в подход "человек-на-чипе", который был исследован несколькими группами в различных конфигурациях. Развивающейся областью, способной глубоко изменить современную медицину, является разработка ОНЧ с индуцированными плюрипотентными стволовыми клетками, полученными от пациентов. Это потенциально может стать сдвигом в парадигме персонализированной медицины и разработки специфических для пациента методов лечения.

Рисунок 2. Системы "орган-на-чипе". a. Схема поперечного сечения специализированного устройства "орган-на-чипе", "легкое-на-чипе", с выделением интерфейса ткани и вакуумных камер для механического воздействия. Адаптировано из Huh et al.. b. Иллюстрация различных органов-на-чипах, в частности, кость, печень, кишечник, легкое, сердце и почка-на-чипе.
Увеличение сложности культивирования клеток, обеспечиваемое микрофлюидикой, открыло возможность более глубокого пространственно-временного анализа клеточного развития и поведения, что еще больше повысило важность таких инструментов, как визуализация живых клеток, обнаружение и анализ метаболизма и микроэкологический мониторинг таких параметров, как pH. Следовательно, долгосрочное культивирование клеток в OoCs перешло из CO2-инкубатора на сцену микроскопа. По мере увеличения сложности систем и углубления доступа к более подробной информации, повышение разрешения и мониторинг систем в реальном времени стали очевидной потребностью. Таким образом, растущая потребность в более тщательном мониторинге температуры, pH и растворенного O2, а также повышенный интерес к лучшему пониманию метаболической активности in situ привели к появлению множества сенсорных решений на кристалле и вне кристалла.
Важность мониторинга pH
Как уже упоминалось ранее, разрыв между доклиническими и клиническими данными приводит к огромным потерям для сектора здравоохранения, а также задерживает доступ пациентов к лечению. Одним из факторов, способствующих возникновению этой глобальной проблемы, являются переменные условия микросреды. Для роста клеточных линий необходим стабильный pH, поскольку кислый pH может необратимо подавлять активность ферментов и синтез ДНК, РНК и белка, что ставит под угрозу жизнеспособность клеток. pH определяется как концентрация свободных ионов H+ в растворе, также называемая активностью протонов, и может быть рассчитана по уравнению Хендерсона-Хассельбальха:
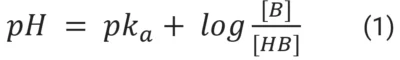
где pka - константа диссоциации кислоты; [HB] - концентрация протонированной формы соединения; и [B] - концентрация непротонированной формы соединения.
Буферные системы способны поддерживать постоянный уровень pH благодаря динамическому равновесию. Равновесие между протонированной и непротонированной формами буфера может смещаться в сторону реакции с образованием нового свободного H+ или высвобождения ионов H+ для компенсации ионов, которые были добавлены или удалены из окружающего раствора. Оба механизма имеют эффект поддержания прежней концентрации свободного H+ на определенном уровне. Если добавление или удаление свободного H+ выходит за пределы порога, который может быть поглощен буфером, pH изменится, т.е. буферная емкость раствора будет превышена. Именно поэтому сложные организмы, такие как млекопитающие, разработали динамические буферные системы, которые регулируют концентрацию буфера в зависимости от потребностей системы. Физиологическая буферная система основана на равновесии CO2/HCO3- (бикарбонатная буферная система, pka= 6,15). Легкие, посредством газообмена CO2, и почки, посредством ионных транспортных белков, отвечают за поддержание соотношения протонированных и непротонированных видов этой буферной системы в гомеостазе, а рН организма в физиологическом диапазоне (рис. 3.a.). Клеточный метаболизм обязательно подкисляет pH микросреды из-за производства и высвобождения лактата, который реагирует с водой с образованием молочной кислоты. По этой причине среды клеточных культур обычно содержат буферную систему для поддержания рН в физиологических условиях. Помимо буфера CO2/HCO3-, среды могут буферироваться нелетучими буферами (NVB), такими как HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) (pKa = 7,3; 37 °C), PIPES (пиперазин-N,N′-бис(2-этансульфоновая кислота); pKa = 6. 7) и MES (2-(N-морфолино)-этансульфоновая кислота; pKa = 6,0)34, однако использование NVBs в средах клеточных культур выходит за рамки данного обзора, подробную работу по этой теме можно найти в Michl et al, 2019.
Бикарбонатная буферная система воспроизводится в лабораториях клеточной биологии с помощью CO2-инкубатора. Эта система работает за счет равновесия между CO2 из богатой CO2 атмосферы инкубатора, который растворяется в среде и реагирует с H2O, образуя угольную кислоту, и NaHCO3, присутствующим в среде (рис. 3.b.). Среды для культивирования клеток имеют разную концентрацию NaHCO3 и требуют разного процентного содержания CO2. Например, DMEM содержит 44 мМ NaHCO3, что требует приблизительно 10% CO2 в атмосфере для поддержания pH близким к 7,4. CO2-инкубаторы обычно настроены на 5% CO2, что поддерживает pH DMEM около 7,6-7,8. Производство молочной кислоты и CO2 здоровыми клетками и буферная способность сыворотки, которую часто добавляют в DMEM, частично компенсируют эту разницу, позволяя выращивать клетки в DMEM с использованием обычных концентраций CO2. Однако последствия этой корректировки не очень хорошо понятны. Внутриклеточный pH клеток находится в близком равновесии с внеклеточным pH микроокружения благодаря трансмембранным белкам-транспортерам ионов. Michl. et al. изучали влияние изменения внеклеточного рН на внутриклеточный рН и пришли к выводу, что клетки восстанавливают баланс внутреннего рН на основе внешнего. Поскольку большинство мишеней для H+ находятся внутриклеточно, это изменение может повлиять на внутриклеточные механизмы и метаболические пути непредсказуемым образом.
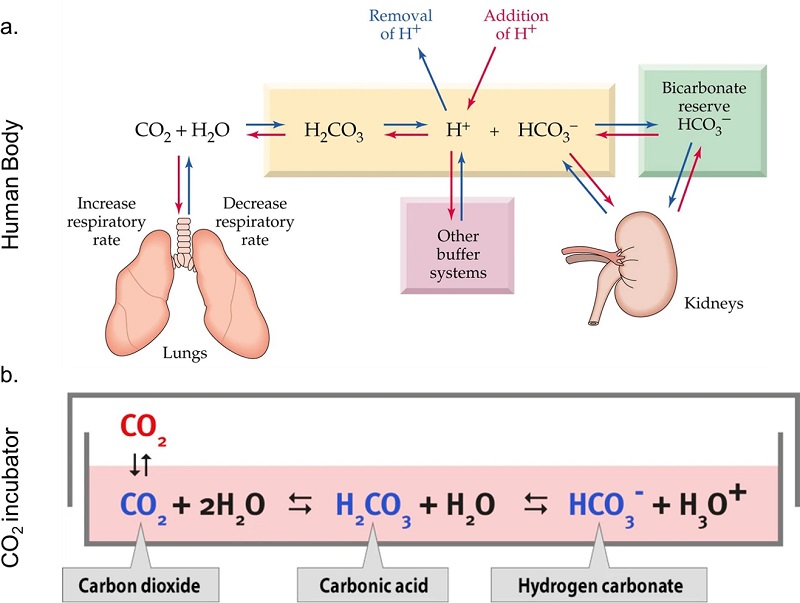
Рисунок 3. Бикарбонатная буферная система. a. Иллюстрация бикарбонатной буферной системы в организме человека, подчеркивающая равновесие, обеспечиваемое легкими и почками. b. Бикарбонатная буферная система в богатой CO2 атмосфере CO2-инкубатора, реагирующая с солью, присутствующей в среде.
Когда система культивирования уменьшается до микронного диапазона в OoCs, существенно уменьшая объемы, мониторинг pH становится еще более важным. Небольшие колебания рН, например, 7,4±0,3, допустимы в традиционной культуре клеток; однако более выраженные диффузионные процессы в микрофлюидической культуре клеток приводят к более выраженному влиянию на жизнеспособность клеток, что заставляет более тщательно следить за важнейшими параметрами окружающей среды.
Мониторинг среды клеточного культивирования с помощью проточных камер
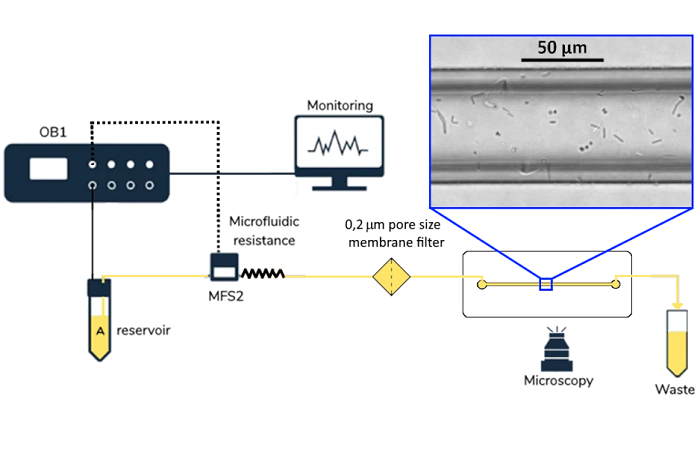
Измерение метаболической активности в микрофлюидной клеточной культуре обычно проводится с помощью растворов на чипе. Например, Велтин разработал микрофизиометрическую систему на микрофлюидном чипе с растворенными электрохимическими датчиками O2 и pH внутри камеры культивирования. Авторы успешно культивировали клетки рака мозга с непрерывным измерением метаболизма клеток в режиме онлайн. Однако эти решения оказываются слишком сложными и дорогостоящими , когда целью является мониторинг среды клеточной культуры, которая не требует такого же уровня детализации информации. Для этого больше подходят микрофлюидные внечиповые решения, такие как микрофлюидные проточные ячейки. Микрофлюидные проточные ячейки могут быть разработаны собственными силами, которые обычно печатаются 3-D, или доступны на коммерческой основе. Формат может варьироваться в зависимости от применения, например, Т-образные переходы для приложений ВЭЖХ или другие геометрические структуры, приспособленные для размещения датчика (рис. 4). Основная цель - разместить датчики на одной линии с микрофлюидной системой, чтобы обеспечить непрерывный мониторинг.
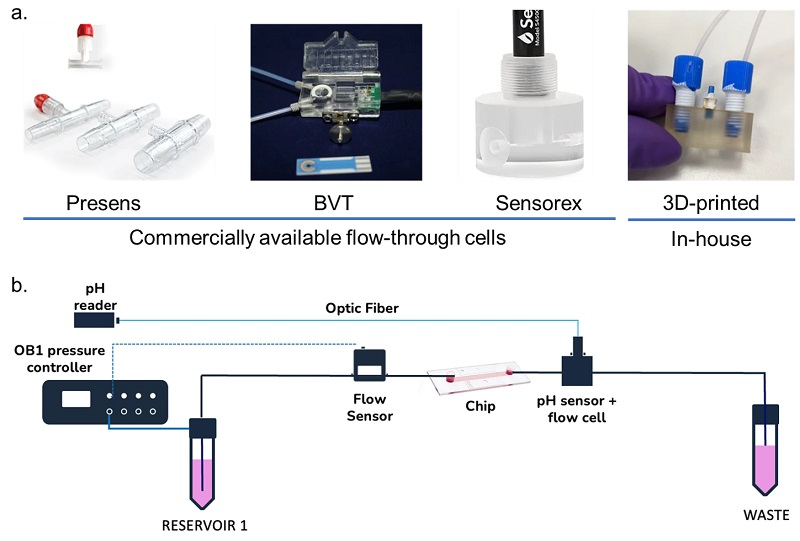
Рисунок 4. Мониторинг pH в клеточной культуре. a. Примеры различных проточных ячеек для мониторинга pH. Первые три коммерчески доступны от различных поставщиков, четвертая была разработана и напечатана на 3D-принтере своими силами. b. Схема микрофлюидной установки с встроенной микрофлюидной проточной ячейкой и датчиком pH.
Хорошим примером является работа Zhang, который разработал "блок физического зондирования", состоящий из датчиков pH, O2 и температуры в проточной камере, разработанной внутри компании, для мониторинга микросреды сложной системы "орган-на-чипе". Система была разработана как модульная платформа для управления двумя органами-на-чипе, подключенными к автоматизированной макетной плате управления потоком. Интересно, что блок определения биомаркеров, т.е. датчики для измерения метаболизма, также находился вне чипа. Платформа была проверена с помощью анализа на скрининг лекарственных препаратов с использованием печени и сердца, подвергнутых воздействию ацетаминофена в течение 5 дней и доксорубицина в течение 24 часов, где биомаркеры цитотоксичности были обнаружены и количественно определены.
Ученые из группы Farooqi напечатали проточную ячейку для определения pH, в которой разместили оптический датчик pH, собранный из имеющихся в продаже деталей, который измерял pH на основе цвета фенолового красного, присутствующего в среде. Цель заключалась в мониторинге системы live-on-chip, предназначенной также для исследования токсичности доксорубицина. Исследователи смогли обнаружить снижение pH, когда клетки подвергались воздействию высоких концентраций препарата по сравнению с контролем. Та же группа провела аналогичную работу с системой "легкое-на-чипе", подтвердив надежность разработанного сенсорного устройства. Также разработали высокопроизводительное устройство для определения pH, состоящее из параллельных микрофлюидных каналов с чувствительной камерой, соединенной с оптическими датчиками pH. Они провели моделирование для определения наилучшей формы чувствительной камеры, в результате чего она приобрела овальную форму, а толщина слоя PDMS также была уменьшена, чтобы минимизировать потери светопропускания. Оптические датчики представляются наиболее распространенным выбором для проточных камер микрофлюидики из-за их независимости от опорных электродов, электрических соединений и скорости потока. Кроме того, они не подвержены биообрастанию, коррозии и интерференции электрохимических сигналов от молекул, присутствующих в среде.
Мониторинг pH вне чипа. Заключение и перспективы
Важный рост технологий "орган-на-чипе" привел к необходимости более тщательного мониторинга того, что происходит внутри чипов. Было разработано несколько решений на чипе и вне чипа, и микрофлюидные проточные ячейки, похоже, являются путем вперед для мониторинга pH микросреды. Сенсоры на чипе подходят для обнаружения метаболической активности, которая может быть выгодна благодаря высокому пространственно-временному разрешению. Однако эти решения слишком дороги и сложны для мониторинга микросреды, который не требует такого же уровня точности. Для мониторинга микросреды наиболее часто используются микрофлюидные проточные кюветы со встроенными оптическими датчиками, которые помещаются в микрофлюидный контур для непрерывного мониторинга в режиме реального времени.