Эта краткая обзорная статья Elveflow основана на статье “Multivesicular Vesicles: Preparation and Applications”, написанной Camila Betterelli Giuliano, Nemanja Cvjetan, Dr. Jessica Ayache, Prof. Dr. Peter Walde и опубликованной в журнале "ChemSystemsChem". Работа выполнена при поддержке Horizon 2020 Marie Skłodowska-Curie Actions Innovative Training Network (ITN), ProtoMet.
Введение в мультивезикулярные микрофлюидные везикулы
Липосомы — это компартменты, состоящие из мембраны, состоящей из амфипатических молекул, часто фосфолипидов, образующих бислой. [P. Walde and S. Ichikawa, 2001], [P. Walde, 2004] Эти компартменты можно классифицировать в зависимости от структуры и размера их мембраны (рис. 1). Например, если они имеют только один бислой, их называют униламеллярными, если несколько - олиголамеллярными или мультиламеллярными везикулами в зависимости от количества слоев. Существует большой интерес к получению униламеллярных везикул из-за их сходства с клеточной мембраной и более легкого для предсказания поведения мембранного транспорта. [P. Walde, 2010] Именно им будет посвящен этот краткий обзор. Униламеллярные везикулы с размерами от 30 до 50 нм в диаметре называют "малыми или сонированными униламеллярными везикулами (SUVs)"; от 50 до 500 нм - "большими униламеллярными везикулами (LUVs)"; и свыше 500 нм - "гигантскими униламеллярными везикулами (GUVs)".
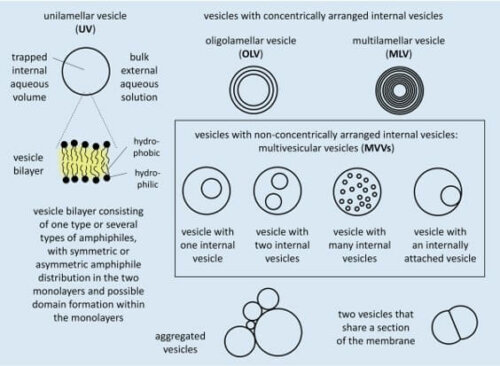
Рисунок 1. Поперечное сечение различных типов липосом на основе структуры мембраны. Заимствовано из Giuliano et al, 2020.
Униламеллярные везикулы широко используются в научных исследованиях в качестве моделей для изучения клеточных мембран и даже вышли на рынок в качестве систем доставки лекарств. [U. Bulbake et al, 2017] Благодаря их универсальности и устоявшейся базе знаний, возрос интерес к изучению более сложных систем на основе липосом. Мультивезикулярные микрофлюидные везикулы представляют собой неконцентрически расположенные иерархические отсеки, состоящие из меньших липосом (SUVs или LUVs) внутри больших липосом (LUVs или GUVs), которые также можно назвать мультивезикулярными везикулами (МVV, рис. 1). Эти сложные компартменты представляют особый интерес, поскольку, с одной стороны, они больше напоминают иерархическую структуру клеток [N.-N. Deng et al., 2017], а с другой стороны, позволяют модулировать профиль высвобождения в системах доставки лекарств. [E. T. Kisak, 2004]

Метод производства мультивезикулярных микрофлюидных везикул
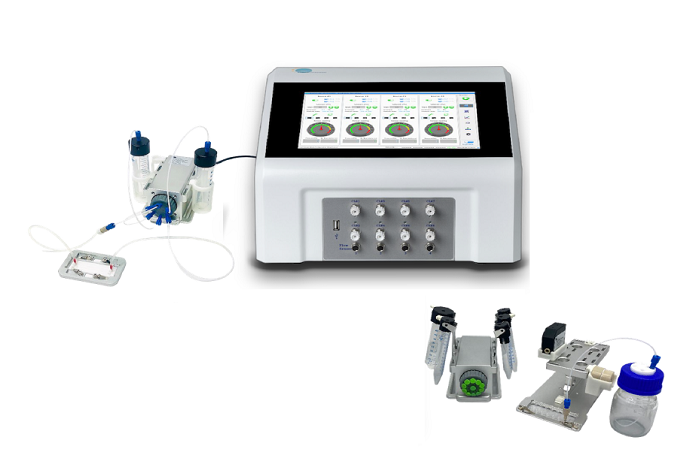
Существует множество способов получения мультивезикул, и они подробно рассмотрены в Giuliano et al, 2020. Здесь мы сосредоточимся на производстве с использованием микрофлюидики из-за повышенного контроля и, следовательно, воспроизводимости, обеспечиваемой этой технологией. Эти характеристики передаются и усиливаются благодаря высоко монодисперсной популяции капель и высокой эффективности инкапсуляции, обеспечиваемой микрофлюидикой [N. Nuti, 2017]. В основе принципа получения липосом в микрофлюидике лежит использование в качестве шаблонов капель воды в масле в воде, или двойных эмульсий [S. Deshpande, 2016].
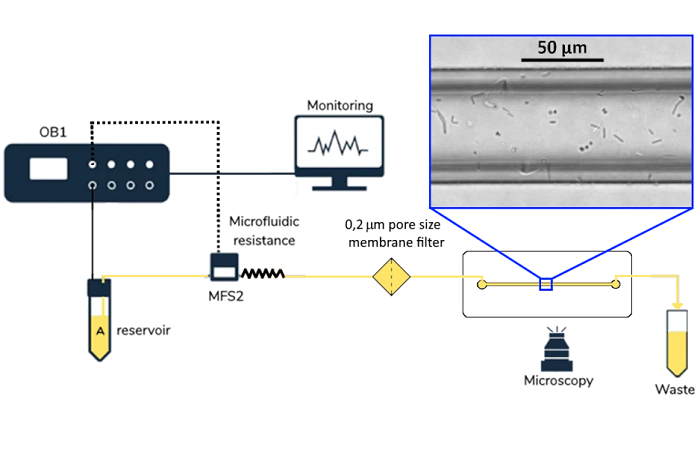
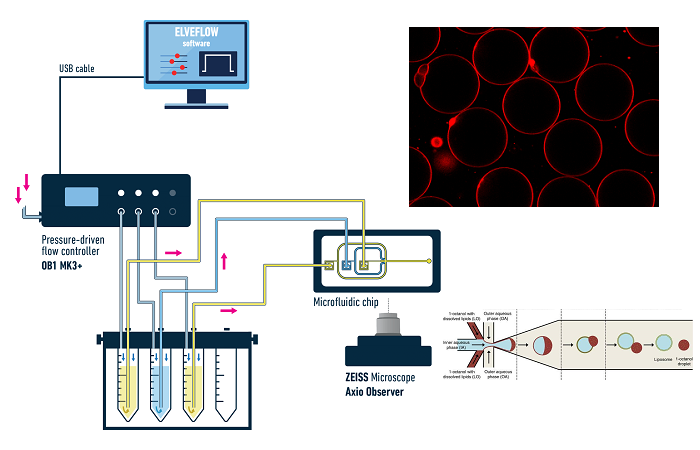
Двойные эмульсии обычно производятся в стеклянных капиллярах [T. Trantidou, 2016] или в чипах PDMS с двумя каналами, поверхность которых обработана таким образом, чтобы быть частично гидрофобной и частично гидрофильной [S. Deshpande, 2016]. В последнем случае раствор, который будет находиться внутри капли вода-масло-в-воде, защемляется масляной фазой в первом соединении. Капля воды в масле движется по гидрофобному каналу до второго пересечения, где масляная фаза будет защемлена внешним водным раствором, образуя каплю воды в масле в воде (рис. 2). Липиды растворяются в масляной фазе. После образования двойной эмульсии необходимо удалить масло из мембраны, оставив только липидный бислой (рис. 2.б). Это удаление может быть спонтанным или запущенным, в зависимости от характеристик участвующих молекул.
Мультивезикулярные микрофлюидические везикулы производятся аналогичным образом. Основное отличие заключается в том, что более мелкие везикулы, которые будут инкапсулированы в более крупные, добавляются во внутреннюю фазу.
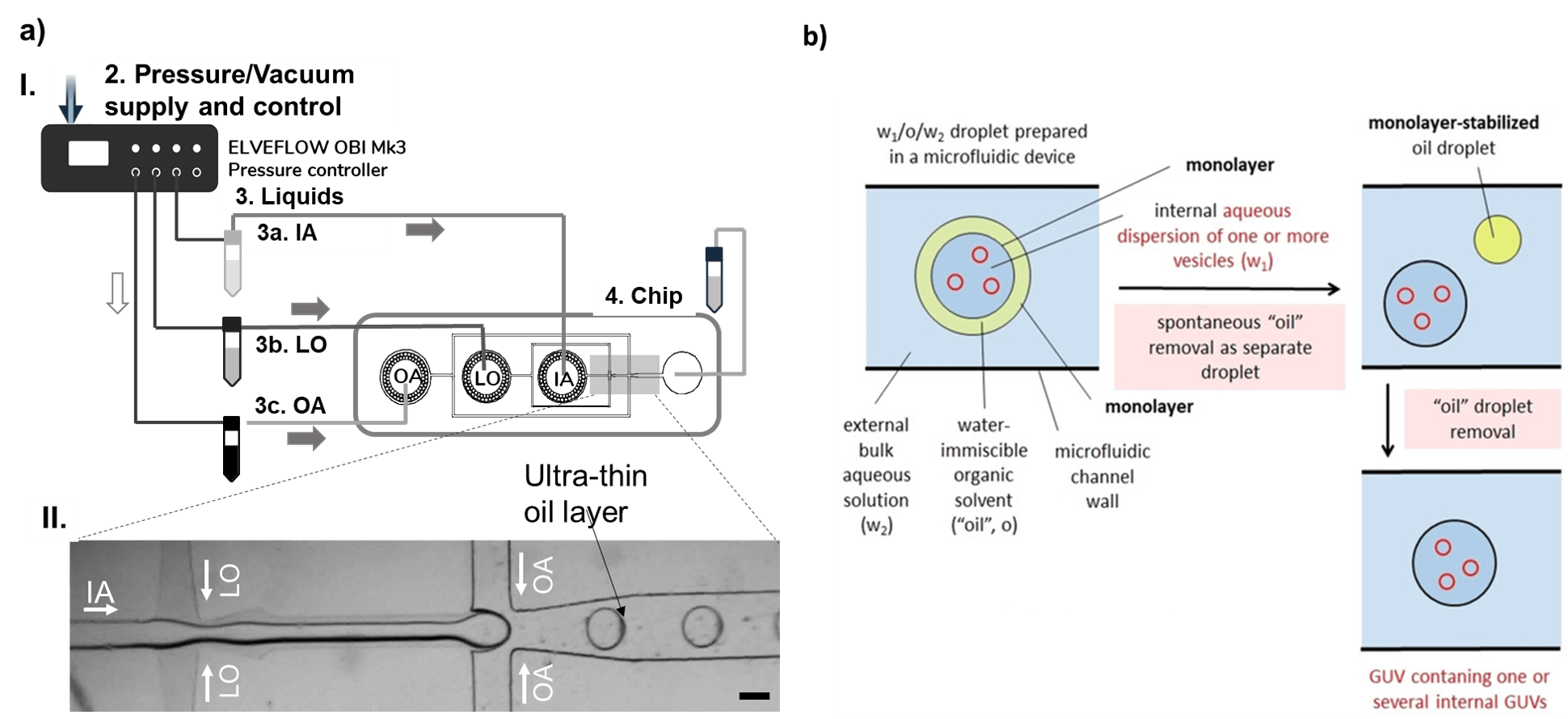
Рисунок 2. Производство мультивезикулярных микрофлюидных везикул. a) Схема микрофлюидной установки для производства двойных эмульсионно-темплатных липосом. Контроллер потока, управляемый давлением, направляет внутренний раствор (IA) к первому стыку, где он обволакивается масляной фазой (LO), а затем пережимается внешней фазой (OA) на втором стыке, образуя двойную эмульсию с ультратонким масляным слоем. б) Схема производства мультивезикулярных микрофлюидных везикул со спонтанным удалением масляного слоя из темплатированных двойных эмульсий. Взято из Giuliano et al, 2020.
Мультивезикулярные микрофлюидические везикулы для доставки лекарств
Липосомы были утверждены и используются в качестве систем доставки лекарств с 1995 года. [U. Bulbake, 2017] Они улучшают терапевтический индекс таких препаратов, как противораковые доксорубицин и даунорубицин, но также известно, что они имеют ограничения в удержании небольших молекулярных препаратов после попадания в системную циркуляцию [E. T. Kisak, 2004]. Считается, что раннее высвобождение вызвано взаимодействием липидного бислоя с ферментами в крови, что приводит к ранней деградации мембраны.
Иерархическая структура мультивезикулярных везикул может помочь решить эту проблему, обеспечивая дополнительный уровень защиты. Кроме того, каждая везикула может быть настроена на ответ на определенный триггер, что повышает уровень гибкости рецептуры. В настоящее время существует одна утвержденная формула, которая использует преимущества этого свойства, - DepoFoam [Q. Ye, J. Asherman, 2000]. Например, было показано, что он позволяет принимать гораздо более высокую дозу неопиоидных обезболивающих средств без ухудшения побочных эффектов [B. M. Ilfeld, 2013]. Он производится традиционными методами эмульгирования, однако производственные проблемы привели к прекращению выпуска некоторых продуктов, в которых DepoFoam использовался в качестве носителя. Потенциально эти проблемы могут быть решены с помощью более совершенной микрофлюидной технологии.
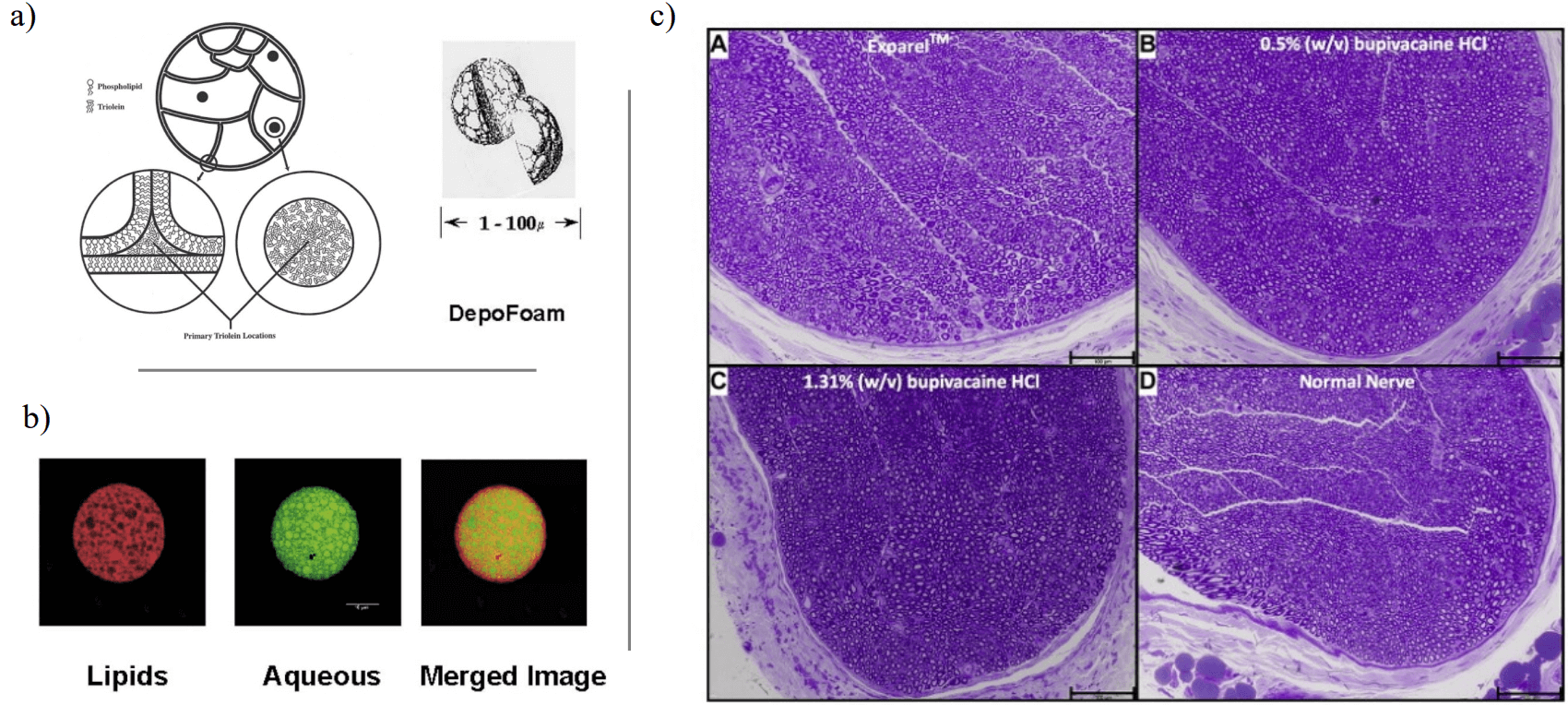
Рисунок 3. Система доставки лекарств DepoFoam. a) Схема иерархической структуры DepoFoam. b) Флуоресцентные изображения липидной структуры (красный); водного содержимого (зеленый); и объединенное изображение. c) In vivo сравнение эффективности DepoFoam (Exparel, коммерческое название) по сравнению с различными концентрациями одного и того же лекарства. Взято из ссылок [51d] и [94] в Giuliano et al, 2020.
Мультивезикулярные микрофлюидические везикулы искусственные клеточноподобные системы
Мультивезикулярные микрофлюидические везикулы близко напоминают конфигурацию живых клеток, что делает их подходящими моделями для искусственных клеточно-подобных систем. [J. W. Hindley et al., 2018 ] Прикладные задачи в этой области варьируется от ограниченных систем химических реакций с целью контроля сложных химических реакций в отсеках до имитации живых клеток, в которых было воспроизведено даже деление клеток. [W. Zong, 2017]
Отличным примером использования мультивезикулярных микрофлюидных везикул в качестве искусственных клеточно-подобных систем является работа Deng et al, 2016. Они сообщили об искусственной клетке с "ядром", способной транскрибировать РНК. Искусственная клетка представляла собой мультивезикулярную везикулу, изготовленную с помощью микрофлюидических стеклянных капилляров.
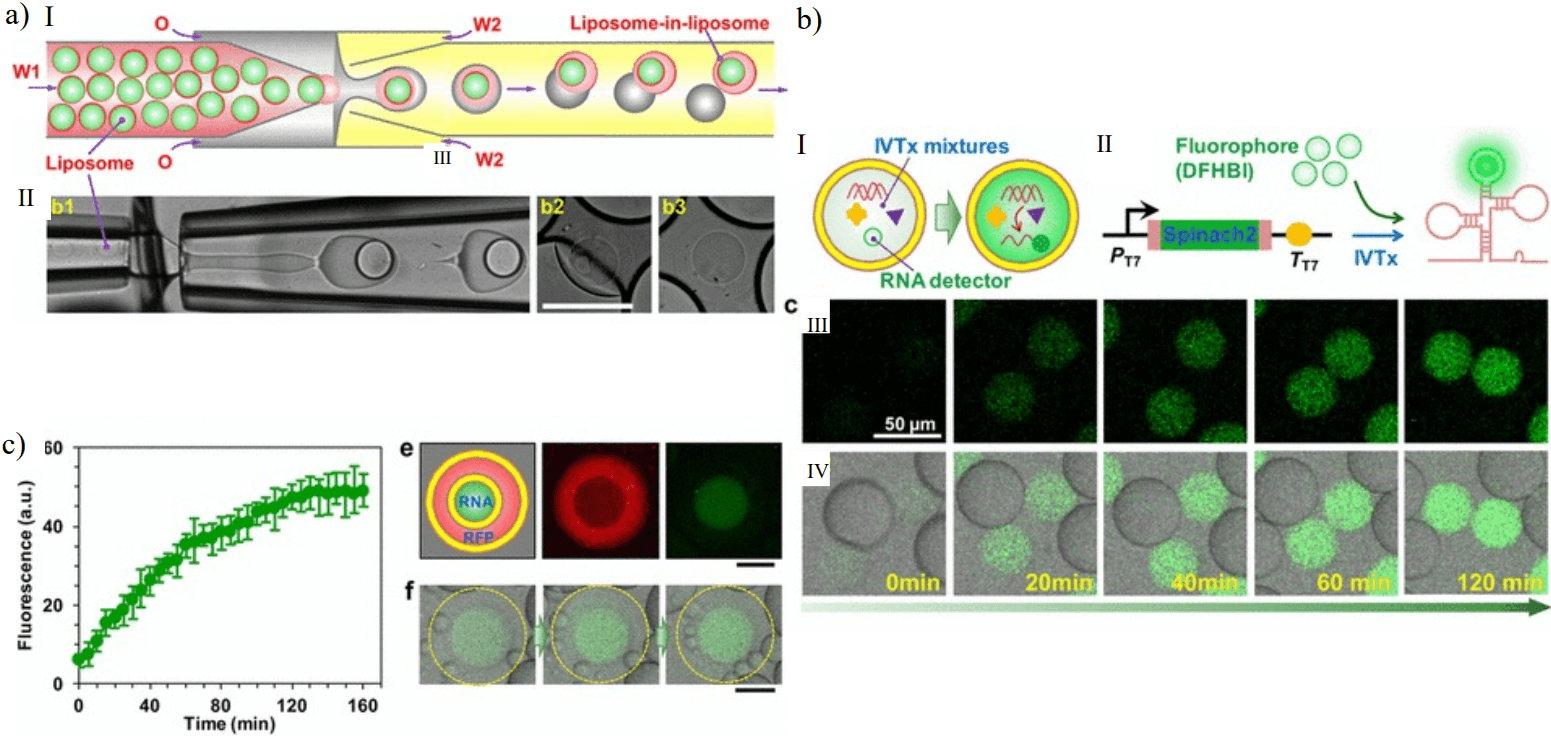
Рисунок 4. Мультивезикулярные микрофлюидные везикулы для искусственных клеточно-подобных систем. a) Схема и репрезентативное изображение производства мультивезикулярных микрофлюидных везикул. b) Производство флуоресцентной РНК в везикулах с течением времени. c) Производство флуоресцентной РНК в "ядре" искусственной клетки. Взято из ссылки [53] в Giuliano et al, 2020.
Заключение и перспективы
Мультивезикулярные микрофлюидические везикулы являются перспективными инструментами для развития систем доставки лекарств и исследования искусственных клеточно-подобных систем. Для доставки лекарств они обеспечивают дополнительную защиту липосом в кровотоке и позволяют точно настроить систему для лучшего высвобождения, принимая во внимание свойства лекарства и путь введения. В случае искусственных клеточно-подобных систем они очень похожи на живые клетки, что позволяет изучать замкнутые системы реакций и более сложные клеточные поведения, такие как деление и транскрипция РНК.
Микрофлюидика имеет преимущества перед традиционными методами эмульгирования благодаря улучшенной монодисперсности липосомальных популяций, что в свою очередь повышает воспроизводимость экспериментов. Она также обеспечивает более высокий контроль над инкапсуляцией и составом отсеков. Эти характеристики могут улучшить результаты во всех обсуждаемых областях применения и будут особенно важны для фармацевтической промышленности, когда технология достигнет промышленных масштабов.